
Struktur, Eigenschaften und Verwendung von Silberoxid (Ag2O)
Das Silberoxid ist eine anorganische Verbindung, deren chemische Formel Ag istzweiO. Die Kraft, die seine Atome bindet, ist vollständig ionischer Natur. Daher besteht es aus einem ionischen Feststoff, bei dem ein Anteil von zwei Kationen Ag vorliegt+ elektrostatisch mit einem Anion O wechselwirkenzwei-.
Das Oxidanion O.zwei-, Es resultiert aus der Wechselwirkung der Silberatome an der Oberfläche mit dem Sauerstoff in der Umgebung. ähnlich wie Eisen und viele andere Metalle. Anstatt sich zu röten und zu Rost zu zerfallen, wird ein Stück oder Juwel aus Silber schwarz, was für Silberoxid charakteristisch ist..

Im obigen Bild sehen Sie beispielsweise eine Tasse aus oxidiertem Silber. Beachten Sie die geschwärzte Oberfläche, obwohl sie immer noch einen gewissen Zierglanz aufweist. Deshalb können auch oxidierte Silbergegenstände für dekorative Zwecke als attraktiv genug angesehen werden.
Die Eigenschaften von Silberoxid sind so, dass sie auf den ersten Blick nicht an der ursprünglichen Metalloberfläche abfressen. Es entsteht bei Raumtemperatur durch einfachen Kontakt mit Luftsauerstoff; und noch interessanter ist, dass es sich bei hohen Temperaturen (über 200 ° C) zersetzen kann..
Dies bedeutet, dass wenn das Glas auf dem Bild erfasst und die Hitze einer intensiven Flamme darauf angewendet würde, es sein silbernes Leuchten wiedererlangen würde. Daher ist seine Bildung ein thermodynamisch reversibler Prozess..
Silberoxid hat auch andere Eigenschaften und geht über seine einfache Formel Ag hinauszweiOder es umfasst komplexe strukturelle Organisationen und eine Vielzahl von Festkörpern. Die AgzweiOder ist es vielleicht neben der AgzweiODER3, der repräsentativste für Silberoxide.
Artikelverzeichnis
- 1 Struktur von Silberoxid
- 1.1 Änderungen mit der Valenznummer
- 2 Physikalische und chemische Eigenschaften
- 2.1 Molekulargewicht
- 2.2 Aussehen
- 2.3 Dichte
- 2.4 Schmelzpunkt
- 2,5 Kps
- 2.6 Löslichkeit
- 2.7 Kovalenter Charakter
- 2.8 Zersetzung
- 3 Nomenklatur
- 3.1 Valencias I und III
- 3.2 Systematische Nomenklatur für komplexe Silberoxide
- 4 Verwendungen
- 5 Referenzen
Struktur von Silberoxid
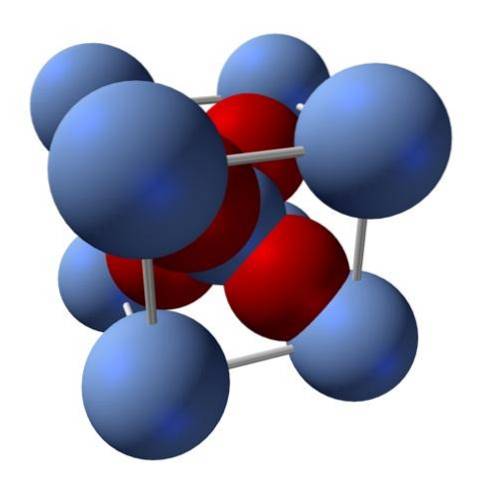
Wie ist seine Struktur? Wie eingangs erwähnt: Es ist ein ionischer Feststoff. Aus diesem Grund kann es in seiner Struktur weder kovalente Ag-O- noch Ag = O-Bindungen geben; da sich die Eigenschaften dieses Oxids drastisch ändern würden, wenn es welche gäbe. Es sind dann Ag-Ionen+ michzwei- im Verhältnis 2: 1 und unter elektrostatischer Anziehung.
Die Struktur von Silberoxid wird folglich durch die Art und Weise bestimmt, in der Ionenkräfte die Ag-Ionen im Raum anordnen.+ michzwei-.
Im obigen Bild gibt es zum Beispiel eine Einheitszelle für ein kubisches Kristallsystem: die Kationen Ag+ sind die silberblauen Kugeln und das O.zwei- die rötlichen Kugeln.
Wenn die Anzahl der Kugeln gezählt wird, wird festgestellt, dass es mit bloßem Auge neun silbrig blaue und vier rote gibt. Es werden jedoch nur die Fragmente der im Würfel enthaltenen Kugeln berücksichtigt. Wenn man diese als Bruchteile der gesamten Kugeln zählt, muss das 2: 1-Verhältnis für Ag eingehalten werdenzweiODER.
Wiederholung der Struktureinheit des AgO-Tetraeders4 umgeben von vier anderen Ag+, Der gesamte schwarze Feststoff wird aufgebaut (Vermeidung der Lücken oder Unregelmäßigkeiten, die diese kristallinen Anordnungen aufweisen können)..
Änderungen mit der Valenznummer
Konzentrieren Sie sich jetzt nicht auf das AgO-Tetraeder4 Auf der AgOAg-Linie (beachten Sie die Eckpunkte des oberen Würfels) ist jedoch zu sehen, dass der Silberoxidfeststoff aus einer anderen Perspektive aus mehreren linear angeordneten Ionenschichten besteht (obwohl sie geneigt sind). All dies als Ergebnis der "molekularen" Geometrie um Ag+.
Dies wurde durch mehrere Studien seiner Ionenstruktur bestätigt..
Silber arbeitet vorwiegend mit der Valenz +1, da beim Verlust eines Elektrons die resultierende elektronische Konfiguration [Kr] 4d ist10, das ist sehr stabil. Andere Valenzen wie Agzwei+ und Ag3+ Sie sind weniger stabil, da sie Elektronen aus nahezu vollen d-Orbitalen verlieren.
Das Ag-Ion3+, es ist jedoch im Vergleich zu Ag relativ weniger instabilzwei+. Tatsächlich kann es in der Gesellschaft von Ag koexistieren+ chemische Anreicherung der Struktur.
Seine Elektronenkonfiguration ist [Kr] 4d8, mit ungepaarten Elektronen so, dass es etwas Stabilität gibt.
Im Gegensatz zu linearen Geometrien um Ag-Ionen+, es wurde gefunden, dass das von Ag-Ionen3+ es ist eine quadratische Ebene. Daher ein Silberoxid mit Ag-Ionen3+ würde aus Schichten bestehen, die aus Quadraten von AgO zusammengesetzt sind4 (keine Tetraeder) elektrostatisch durch AgOAg-Linien verbunden; Dies ist der Fall bei Ag4ODER4 oder AgzweiO ∙ AgzweiODER3 mit monokliner Struktur.
Physikalische und chemische Eigenschaften

Das Abkratzen der Oberfläche des Silberbechers im Hauptbild würde zu einem Feststoff führen, der nicht nur schwarz ist, sondern auch Braun- oder Brauntöne aufweist (oberes Bild). Einige der derzeit gemeldeten physikalischen und chemischen Eigenschaften sind folgende:
Molekulargewicht
231,735 g / mol
Aussehen
Schwarzbrauner Feststoff in Pulverform (beachten Sie, dass er trotz seines ionischen Feststoffs kein kristallines Aussehen aufweist). Es ist geruchlos und mit Wasser gemischt verleiht es einen metallischen Geschmack
Dichte
7,14 g / ml.
Schmelzpunkt
277-300 ° C. Sicherlich schmilzt es zu festem Silber; das heißt, es zersetzt sich wahrscheinlich, bevor es das flüssige Oxid bildet.
Kps
1,52 ∙ 10-8 in Wasser bei 20 ° C. Es ist daher eine in Wasser kaum lösliche Verbindung.
Löslichkeit
Wenn Sie sich das Bild seiner Struktur genau ansehen, werden Sie feststellen, dass die Kugeln von Agzwei+ michzwei- Sie unterscheiden sich nicht fast in der Größe. Dies führt dazu, dass nur kleine Moleküle das Innere des Kristallgitters passieren können, wodurch es in fast allen Lösungsmitteln unlöslich wird. außer für diejenigen, bei denen es reagiert, wie Basen und Säuren.
Kovalenter Charakter
Obwohl wiederholt gesagt wurde, dass Silberoxid eine ionische Verbindung ist, widersprechen bestimmte Eigenschaften, wie der niedrige Schmelzpunkt, dieser Behauptung..
Sicherlich zerstört die Berücksichtigung des kovalenten Charakters nicht das, was für seine Struktur erklärt wurde, da es ausreichen würde, die Struktur von Ag hinzuzufügenzweiOder ein Modell von Kugeln und Balken, um kovalente Bindungen anzuzeigen.
Ebenso die Tetraeder- und Quadratebenen AgO4, sowie AgOAg-Linien würden sie durch kovalente Bindungen (oder ionische kovalente) verbunden sein.
In diesem Sinne hat die AgzweiOder es wäre tatsächlich ein Polymer. Es wird jedoch empfohlen, es als einen ionischen Feststoff mit kovalentem Charakter zu betrachten (dessen Art der Bindung bis heute eine Herausforderung darstellt)..
Zersetzung
Zuerst wurde erwähnt, dass seine Bildung thermodynamisch reversibel ist, so dass es Wärme absorbiert, um in seinen metallischen Zustand zurückzukehren. All dies kann durch zwei chemische Gleichungen für solche Reaktionen ausgedrückt werden:
4Ag (s) + O.zwei(g) => 2AgzweiO (s) + Q.
2AgzweiO (s) + Q => 4Ag (s) + O.zwei(G)
Wobei Q Wärme in der Gleichung darstellt. Dies erklärt, warum das Feuer, das die Oberfläche des oxidierten Silberbechers verbrennt, ihn zu seinem silbernen Schimmer zurückbringt..
Daher ist es schwierig anzunehmen, dass es Ag gibtzweiO (l) da es sich sofort von der Hitze zersetzen würde; Es sei denn, der Druck ist zu hoch, um die braunschwarze Flüssigkeit zu erhalten.
Nomenklatur
Als die Möglichkeit von Ag-Ionen eingeführt wurdezwei+ und Ag3+ zusätzlich zu der gemeinsamen und vorherrschenden Ag+, Der Begriff "Silberoxid" scheint nicht mehr ausreichend zu sein, um sich auf Ag zu beziehenzweiODER.
Dies liegt am Ag-Ion+ ist häufiger als die anderen, so dass die Ag genommen wirdzweiOder als einziges Oxid; das ist überhaupt nicht richtig.
Wenn Agzwei+ da es aufgrund seiner Instabilität praktisch nicht existiert, werden wir nur die Ionen mit den Valenzen +1 und +3 haben; d.h. Ag (I) und Ag (III).
Valencias I und III
Da Ag (I) das mit der niedrigsten Wertigkeit ist, wird es durch Hinzufügen des Suffix -oso zu seinem Namen benannt argentum. So ist die AgzweiEntweder ist es: Silberoxid oder gemäß der systematischen Nomenklatur Diplomatenmonoxid.
Wenn Ag (III) vollständig ignoriert wird, sollte seine traditionelle Nomenklatur lauten: Silberoxid anstelle von Silberoxid.
Da Ag (III) die höchste Wertigkeit ist, wird dem Namen das Suffix -ico hinzugefügt. So ist die AgzweiODER3 ist: Silberoxid (2 Ag-Ionen3+ mit drei O'szwei-). Außerdem würde sein Name gemäß der systematischen Nomenklatur lauten: diplata trioxide.
Wenn die Struktur von AgzweiODER3, Es kann angenommen werden, dass es das Produkt der Oxidation durch Ozon, OR ist3, anstelle von Sauerstoff. Daher muss sein kovalenter Charakter größer sein, da es sich um eine kovalente Verbindung mit Ag-O-O-O-Ag- oder Ag-O-Bindungen handelt.3-Ag.
Systematische Nomenklatur für komplexe Silberoxide
Die AgO, auch als Ag geschrieben4ODER4 oder AgzweiO ∙ AgzweiODER3, Es ist ein Silberoxid (I, III), da es sowohl +1 als auch +3 Valenzen aufweist. Sein Name gemäß der systematischen Nomenklatur wäre: Tetra-Silber-Tetraoxid.
Diese Nomenklatur ist eine große Hilfe, wenn es um andere, stöchiometrisch komplexe Silberoxide geht. Angenommen, die beiden Feststoffe 2AgzweiO ∙ AgzweiODER3 und AgzweiO ∙ 3AgzweiODER3.
Das erste angemessener zu schreiben wäre: Ag6ODER5 (Zählen und Hinzufügen der Atome von Ag und O). Sein Name wäre dann Hexaplate-Pentoxid. Es ist zu beachten, dass dieses Oxid eine weniger reiche Silberzusammensetzung als Ag hatzweiOder (6: 5 < 2:1).
Beim Schreiben des zweiten Volumenkörpers auf andere Weise wäre es: Ag8ODER10. Sein Name wäre Octa-Silber-Decaoxid (mit einem Verhältnis von 8:10 oder 4: 5). Dieses hypothetische Silberoxid wäre "sehr oxidiert".
Anwendungen
Studien auf der Suche nach neuen und hoch entwickelten Verwendungsmöglichkeiten für Silberoxid dauern bis heute an. Einige seiner Verwendungen sind unten aufgeführt:
-Es löst sich in Ammoniak, Ammoniumnitrat und Wasser unter Bildung des Tollens-Reagens. Dieses Reagenz ist ein nützliches Werkzeug für die qualitative Analyse in Laboratorien für organische Chemie. Es ermöglicht die Bestimmung des Vorhandenseins von Aldehyden in einer Probe unter Bildung eines "Silberspiegels" im Reagenzglas als positive Reaktion..
-Zusammen mit metallischem Zink bildet es die primären Zink-Silberoxid-Batterien. Dies ist vielleicht eine der häufigsten und häuslichsten Anwendungen.
-Es dient als Gasreiniger und absorbiert beispielsweise COzwei. Beim Erhitzen werden eingeschlossene Gase freigesetzt und können mehrfach wiederverwendet werden.
-Aufgrund der antimikrobiellen Eigenschaften von Silber ist sein Oxid für Bioanalyse- und Bodenreinigungsstudien nützlich..
-Es ist ein mildes Oxidationsmittel, das Aldehyde zu Carbonsäuren oxidieren kann. Es wird auch in der Hofmann-Reaktion (von tertiären Aminen) verwendet und ist an anderen organischen Reaktionen beteiligt, entweder als Reagenz oder als Katalysator..
Verweise
- Bergstresser M. (2018). Silberoxid: Formel, Zersetzung & Bildung. Studie. Wiederhergestellt von: study.com
- Autoren und Herausgeber der Bände III / 17E-17F-41C. (s.f.). Silberoxid (Ag (x) O (y)) Kristallstruktur, Gitterparameter. (Numerische Daten und funktionale Beziehungen in Wissenschaft und Technologie), Band 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal und Snehasis Jana. (2015). Der mögliche Einfluss der Biofeld-Energiebehandlung auf die physikalischen und thermischen Eigenschaften von Silberoxidpulver. Internationale Zeitschrift für biomedizinische Wissenschaft und Technik. Band 3, Nr. 5, S. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Zersetzung von Silberoxid. Universität von Oregon. Wiederhergestellt von: chemdemos.uoregon.edu
- Feuerstein, Deyanda. (24. April 2014). Verwendung von Silberoxidbatterien. Wissenschaft. Wiederhergestellt von: sciencing.com
- Salman Montasir E. (2016). Untersuchung einiger optischer Eigenschaften von Silberoxid (Ag2o) mit einem UVVisible-Spektrophotometer. [PDF]. Wiederhergestellt von: iosrjournals.org
- Bard Allen J. (1985). Standardpotentiale in wässriger Lösung. Marcel Dekker. Wiederhergestellt von: books.google.co.ve

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.