
Acetanilid (C8H9NO) Struktur, Eigenschaften, Synthese
Das Acetanilid (C8H9NO) ist ein aromatisches Amid, das mehrere zusätzliche Namen erhält: N-Acetylarylamin, N-Phenylacetamid und Acetanil. Es wird als geruchloser Feststoff in Form von Flocken präsentiert, seine chemische Natur ist Amid und als solches kann es bei Reaktion mit starken Reduktionsmitteln brennbare Gase bilden..
Darüber hinaus ist es eine schwache Base, die mit Dehydratisierungsmitteln wie P reagieren kannzweiODER5 ein Nitril entstehen lassen. Es wurde festgestellt, dass Acetanilid eine analgetische und fiebersenkende Wirkung hat und 1886 unter dem Namen Antifebrina von A. Cahn und P. Hepp verwendet wurde..

1899 wurde Acetylsalicylsäure (Aspirin) auf den Markt gebracht, die die gleichen therapeutischen Wirkungen wie Acetanilid hatte. Da die Verwendung von Acetanilid mit dem Auftreten von Zyanose bei Patienten zusammenhängt - eine Folge der Acetanilid-induzierten Methämoglobinämie -, wurde die Verwendung ausgeschlossen..
Anschließend wurde festgestellt, dass die analgetische und fiebersenkende Wirkung von Acetanilid in einem Metaboliten namens Paracetamol (Acetoaminophen) lag, der keine toxischen Wirkungen hatte, wie von Axelrod und Brodie vorgeschlagen..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Resonanzstrukturen und intermolekulare Wechselwirkungen
- 2 Chemische Eigenschaften
- 2.1 Molekulargewicht
- 2.2 Chemische Beschreibung
- 2.3 Geruch
- 2.4 Geschmack
- 2,5 Siedepunkt
- 2.6 Schmelzpunkt
- 2.7 Flammpunkt oder Flammpunkt
- 2.8 Dichte
- 2.9 Dampfdichte
- 2.10 Dampfdruck
- 2.11 Stabilität
- 2.12 Volatilität
- 2.13 Selbstentzündung
- 2.14 Zersetzung
- 2,15 pH
- 2.16 Löslichkeit
- 3 Synthese
- 4 Anwendungen
- 5 Referenzen
Chemische Struktur
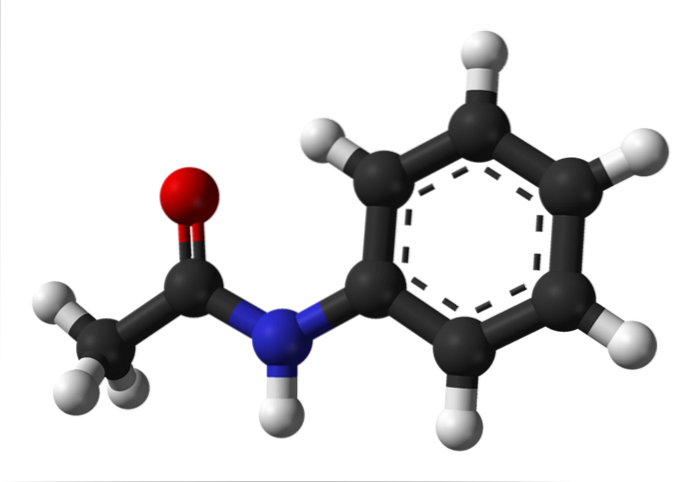
Das obere Bild zeigt die chemische Struktur von Acetanilid. Rechts ist der hexagonale aromatische Benzolring (mit gepunkteten Linien) und links der Grund, warum die Verbindung aus einem aromatischen Amid besteht: der Acetamidogruppe (HNCOCH)3).
Die Acetamidogruppe verleiht dem Benzolring einen größeren polaren Charakter; das heißt, es erzeugt ein Dipolmoment im Acetanilidmolekül.
Warum? Weil Stickstoff elektronegativer ist als jedes der Kohlenstoffatome im Ring und auch an die Acylgruppe gebunden ist, deren O-Atom auch die Elektronendichte anzieht.
Andererseits liegt aufgrund der sp-Hybridisierung fast die gesamte Molekülstruktur von Acetanilid auf derselben Ebenezwei der Atome, aus denen es besteht.
Es gibt eine Ausnahme, die mit denen der -CH-Gruppe verknüpft ist3, deren Wasserstoffatome die Eckpunkte eines Tetraeders bilden (die weißen Kugeln ganz links kommen aus der Ebene heraus).
Resonanzstrukturen und intermolekulare Wechselwirkungen
Das einsame Paar ohne Teilung am N-Atom zirkuliert durch das π-System des aromatischen Rings und erzeugt mehrere Resonanzstrukturen. Eine dieser Strukturen führt jedoch zu einer negativen Ladung am O-Atom (elektronegativer) und einer positiven Ladung am N-Atom..
So gibt es Resonanzstrukturen, in denen sich eine negative Ladung im Ring bewegt, und eine andere, in der sie sich im O-Atom befindet. Infolge dieser "elektronischen Asymmetrie", die mit molekularer Asymmetrie einhergeht, interagiert Acetanilid intermolekular durch Dipol -Dipolkräfte.
Wasserstoffbrücken (N-H-O-…) zwischen zwei Acetanilidmolekülen sind jedoch tatsächlich die vorherrschende Kraft in ihrer Kristallstruktur..
So bestehen Acetanilidkristalle aus orthorhombischen Einheitszellen von acht Molekülen, die durch ihre Wasserstoffbrückenbindungen in Form eines „flachen Bandes“ orientiert sind..
Dies kann sichtbar gemacht werden, indem ein Acetanilidmolekül parallel übereinander gelegt wird. Also, wie die HNCOCH-Gruppen3 räumlich überlappen, bilden sie Wasserstoffbrücken.
Zusätzlich kann zwischen diesen beiden Molekülen auch ein Drittel "rutschen", wobei sein aromatischer Ring auf die gegenüberliegende Seite zeigt..
Chemische Eigenschaften
Molekulargewicht
135,166 g / mol.
Chemische Beschreibung
Festes Weiß oder cremefarben. Bildet glänzende weiße Flocken oder ein weißes kristallines Pulver.
Geruch
Toilette.
Geschmack
Leicht würzig.
Siedepunkt
304 ° C bis 760 mmHg (579 ° F bis 760 mmHg).
Schmelzpunkt
114,3 ° C (237,7 ° F).
Flammpunkt oder Flammpunkt
169 ° C (337 ° F). Messung in offenem Glas.
Dichte
1.219 mg / ml bei 15 ° C (1.219 mg / ml bei 59 ° F)
Wasserdampfdichte
4,65 relativ zu Luft.
Dampfdruck
1 mmHg bei 237ºF, 1,22 × 10-3 mmHg bei 25ºC, 2 Pa bei 20ºC.
Stabilität
Es unterliegt einer chemischen Umlagerung, wenn es UV-Licht ausgesetzt wird. Wie verändert sich die Struktur? Die Acetylgruppe bildet an den ortho- und para-Positionen neue Bindungen am Ring. Darüber hinaus ist es luftstabil und mit starken Oxidationsmitteln, Ätzmitteln und Laugen nicht verträglich..
Volatilität
Bei 95 ºC deutlich flüchtig.
Selbstentzündung
1004ºF.
Zersetzung
Es zersetzt sich beim Erhitzen und gibt einen hochgiftigen Rauch ab.
pH
5 - 7 (10 g / l H.zweiOder bei 25 ºC)
Löslichkeit
- In Wasser: 6,93 × 103 mg / ml bei 25 ° C..
- Löslichkeit von 1 g Acetanilid in verschiedenen Flüssigkeiten: in 3,4 ml Alkohol, 20 ml kochendem Wasser, 3 ml Methanol, 4 ml Aceton, 0,6 ml kochendem Alkohol, 3,7 ml Chloroform, 5 ml Gliecerin, 8 ml 47 ml Benzol und 18 ml Ether. Chloralhydrat erhöht die Löslichkeit von Acetanilid in Wasser.
Synthese
Es wird durch Umsetzung von Essigsäureanhydrid mit Acetanilid synthetisiert. Diese Reaktion erscheint in vielen Texten der Organischen Chemie (Vogel, 1959):
C.6H.5NHzwei + (CH3CO)zweiO => C.6H.5NHCOCH3 + CH3COOH
Anwendungen
-Es ist ein Inhibitor des Zersetzungsprozesses von Wasserstoffperoxid (Wasserstoffperoxid)..
-Stabilisiert Celluloseesterlacke.
-Es greift als Vermittler in die Beschleunigung der Kautschukproduktion ein. Ebenso ist es ein Vermittler bei der Synthese einiger Farbstoffe und Kampfer..
-Wirkt als Vorstufe bei der Synthese von Penicillin.
-Es wird zur Herstellung von 4-Acetamidosulfonylbenzolchlorid verwendet. Acetanilid reagiert mit Chlorsulfonsäure (HSO)3Cl), wodurch 4-Aminosulfonylbenzolchlorid erzeugt wird. Dieses reagiert mit Ammoniak oder einem primären organischen Amin unter Bildung von Sulfonamiden..
-Es wurde im 19. Jahrhundert experimentell in der Entwicklung der Fotografie eingesetzt.
-Acetanilid wird als Marker für elektroosmotische Flüsse (EOF) in der Kapillarelektrophorese zur Untersuchung der Verbindung zwischen Arzneimitteln und Proteinen verwendet..
-Kürzlich (2016) wurde Acetanilid in Experimenten mit 1- (ω-Phenoxyalkyluracil) verknüpft, um die Replikation des Hepatitis-C-Virus zu hemmen. Acetanilid bindet an Position 3 des Pyrimidinrings.
-Die experimentellen Ergebnisse zeigen eine Verringerung der Replikation des viralen Genoms unabhängig vom viralen Genotyp..
-Bevor die Toxizität von Acetanilid identifiziert wurde, wurde es ab 1886 als Analgetikum und Antipyretikum verwendet. Später (1891) wurde es bei der Behandlung von chronischer und akuter Bronchitis durch Grün verwendet.
Verweise
- J. Brown & amp; D.E.C. Corbridge. (1948). Kristallstruktur von Acetanilid: Verwendung von polarisierter Infrarotstrahlung. Nature Volume 162, Seite 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) Die Verwendung von Acetanilid bei der Behandlung von akuter und chronischer Bronchitis. Lancet 137 (3539): 1424 & ndash; 1426.
- Magri, A. et al. (2016). Erforschung von Acetanilid-Derivaten von 1- (ω-Phenoxyalkyl) uracilen als neuartige Inhibitoren der Hepatitis-C-Virus-Replikation. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilid. Abgerufen am 5. Juni 2018 von: sigmaaldrich.com
- SIDS-Erstbewertungsbericht für das 13. SIAM. Acetanilid. [PDF]. Abgerufen am 5. Juni 2018 von: inchem.org
- Wikipedia. (2018). Acetanilid. Abgerufen am 05. Juni 2018 von: en.wikipedia.org
- PubChem. (2018). Acetanilid. Abgerufen am 5. Juni 2018 von: pubchem.ncbi.nlm.nih.gov


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.