
Struktur, Eigenschaften, Verwendung, Herstellung von Siliziumoxid (SiO2)
Das Siliziumoxid Es ist ein anorganischer Feststoff, der durch die Vereinigung eines Siliziumatoms und zweier Sauerstoffatome gebildet wird. Seine chemische Formel lautet SiOzwei. Diese natürliche Verbindung wird auch als Siliciumdioxid oder Siliciumdioxid bezeichnet..
Das SiOzwei Es ist das am häufigsten vorkommende Mineral in der Erdkruste, da Sand aus Kieselsäure besteht. Kieselsäure kann je nach Struktur kristallin oder amorph sein. Es ist in Wasser unlöslich, löst sich jedoch in Laugen und in Flusssäure HF.

Das SiOzwei Es ist auch in der Struktur bestimmter Pflanzen, Bakterien und Pilze vorhanden. Auch in Skeletten mariner Organismen. Neben Sand gibt es auch andere Arten von Steinen, bei denen es sich um Kieselsäure handelt.
Kieselsäure ist weit verbreitet und erfüllt eine Vielzahl von Funktionen. Am weitesten verbreitet ist die Verwendung als Filtermaterial für Flüssigkeiten wie Öle und Erdölprodukte, Getränke wie Bier und Wein sowie Fruchtsäfte..
Aber es hat viele andere Anwendungen. Eine der nützlichsten und wichtigsten ist die Herstellung von bioaktiven Gläsern, mit denen "Gerüste" hergestellt werden können, in denen Knochenzellen wachsen, um durch Zufall oder Krankheit fehlende Knochenstücke zu produzieren..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3.7 Chemische Eigenschaften
- 4 Präsenz in der Natur
- 4.1 Andere Arten von natürlicher Kieselsäure
- 5 Erhalten
- 6 Verwendungen
- 6.1 In verschiedenen Anwendungen
- 6.2 In der Lebensmittelindustrie
- 6.3 In der pharmazeutischen Industrie
- 6.4 In der Kosmetik- und Körperpflegeindustrie
- 6.5 In therapeutischen Anwendungen
- 7 Risiken
- 8 Referenzen
Struktur
Siliziumdioxid SiOzwei ist ein Molekül aus drei Atomen, bei dem das Siliciumatom mit kovalenten Bindungen an zwei Sauerstoffatome gebunden ist.
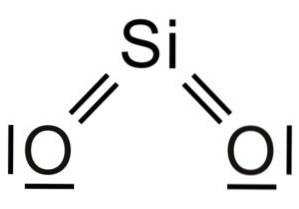
Die Struktureinheit von festem Siliciumdioxid als solchem ist ein Tetraeder, bei dem ein Siliciumatom von 4 Sauerstoffatomen umgeben ist.
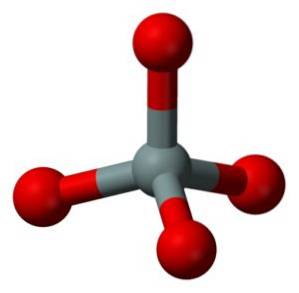
Tetraeder werden miteinander verbunden, indem die Sauerstoffatome ihrer zusammenhängenden Eckpunkte geteilt werden.
Deshalb teilt ein Siliziumatom jedes der 4 Sauerstoffatome in zwei Hälften und dies erklärt die Beziehung in der Verbindung von 1 Siliziumatom zu 2 Sauerstoffatomen (SiO)zwei).

SiO-Verbindungenzwei werden in zwei Gruppen unterteilt: kristalline Kieselsäure und amorphe Kieselsäure.
Kristalline Siliciumdioxidverbindungen weisen sich wiederholende Musterstrukturen aus Silicium und Sauerstoff auf.
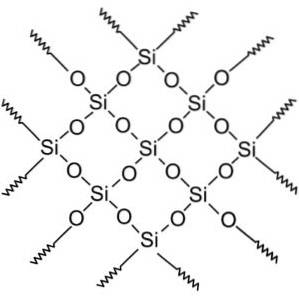
Alle Siliciumdioxidkristalle können als Riesenmoleküle betrachtet werden, bei denen das Kristallgitter sehr stark ist. Tetraeder können auf verschiedene Weise verknüpft werden, wodurch verschiedene kristalline Formen entstehen.
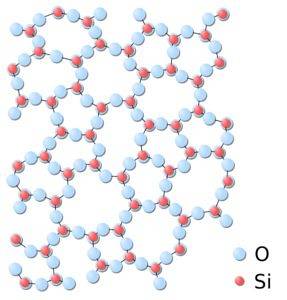
In amorphem Siliciumdioxid sind die Strukturen zufällig gebunden, ohne einem definierten regelmäßigen Muster zwischen den Molekülen zu folgen, und diese stehen in einer unterschiedlichen räumlichen Beziehung zueinander..
Nomenklatur
-Siliziumoxid
-Siliciumdioxid
-Silica
-Quarz
-Tridymite
-Cristobalita
-Dioxosilan
Eigenschaften
Körperlicher Status
Farblos bis grau fest.

Molekulargewicht
60,084 g / mol
Schmelzpunkt
1713 ºC
Siedepunkt
2230 ºC
Dichte
2,17-2,32 g / cm3
Löslichkeit
Nicht in Wasser löslich. Amorphes Siliciumdioxid ist in Alkalien löslich, insbesondere wenn es fein verteilt ist. Löslich in Flusssäure HF.
Amorphes Siliciumdioxid ist weniger hydrophil, dh weniger mit Wasser verwandt als kristallin.
Chemische Eigenschaften
Das SiOzwei o Kieselsäure ist gegenüber den meisten Substanzen im Wesentlichen inert und sehr wenig reaktiv.
Widersteht dem Angriff von Chlor Clzwei, Brom Brzwei, Wasserstoff H.zwei und von den meisten Säuren bei Raumtemperatur oder etwas höher. Es wird von Fluor F angegriffenzwei, Flusssäure HF und Laugen wie Natriumcarbonat NazweiCO3.
Das SiOzwei Es kann sich mit metallischen Elementen und Oxiden zu Silikaten verbinden. Wenn Siliciumdioxid bei etwa 1300ºC mit Alkalimetallcarbonaten verschmolzen wird, werden Alkalisilicate erhalten und CO wird freigesetzt.zwei.
Es ist nicht brennbar. Hat eine geringe Wärmeleitfähigkeit.
Präsenz in der Natur
Die Hauptquelle für Kieselsäure in der Natur ist Sand.
Das SiOzwei oder Kieselsäure liegt in Form von drei kristallinen Sorten vor: Quarz (die stabilste), Tridymit und Cristobalit. Amorphe Formen von Siliciumdioxid sind Achat, Jaspis und Onyx. Opal ist eine amorphe hydratisierte Kieselsäure.
Es gibt auch die sogenannte biogene Kieselsäure, die von lebenden Organismen erzeugt wird. Quellen dieser Art von Kieselsäure sind Bakterien, Pilze, Kieselalgen, Seeschwämme und Pflanzen.
Die glänzenden, harten Teile von Bambus und Stroh enthalten Kieselsäure, und die Skelette einiger Meeresorganismen enthalten ebenfalls einen hohen Anteil an Kieselsäure. Am wichtigsten sind jedoch Kieselgur.
Kieselgur sind geologische Produkte von verfallenen einzelligen Organismen (Algen).
Andere Arten von natürlicher Kieselsäure
In der Natur gibt es auch folgende Sorten:
- Glaskieselsäuren, die vulkanische Gläser sind
- Die Lechaterielite sind natürliche Gläser, die durch Verschmelzen von siliciumhaltigem Material unter dem Einfluss von Meteoriten hergestellt werden
- Quarzglas, bei dem es sich um Quarzglas handelt, das auf die flüssige Phase erhitzt und abgekühlt wird, ohne dass es kristallisiert
Erhalten
Kieselsäure aus Sand wird direkt aus Steinbrüchen gewonnen.

Kieselgur oder Kieselgur wird auf diese Weise auch unter Verwendung von Baggern und ähnlichen Geräten gewonnen..
Amorphes Siliciumdioxid wird aus wässrigen Lösungen von Alkalimetallsilicat (wie Natrium-Na) durch Neutralisation mit Säure wie Schwefelsäure H hergestelltzweiSW4, Salzsäure HCl oder Kohlendioxid COzwei.
Wenn der endgültige pH-Wert der Lösung neutral oder alkalisch ist, wird ausgefälltes Siliciumdioxid erhalten. Wenn der pH-Wert sauer ist, wird Kieselgel erhalten.
Quarzstaub wird durch Verbrennung einer flüchtigen Siliciumverbindung, üblicherweise Siliciumtetrachlorid-SiCl, hergestellt4. Ausgefallene Kieselsäure wird aus einer wässrigen Lösung von Silikaten erhalten, zu denen Säure gegeben wird.
Kolloidales Siliciumdioxid ist eine stabile Dispersion kolloidaler Partikel von amorphem Siliciumdioxid in einer wässrigen Lösung.
Anwendungen
In verschiedenen Anwendungen
Silica oder SiOzwei Es hat eine Vielzahl von Funktionen, zum Beispiel dient es unter anderem als Schleifmittel, Absorptionsmittel, Antibackmittel, Füllstoff, Trübungsmittel und zur Förderung der Suspension anderer Substanzen..
Es wird zum Beispiel verwendet:
-Bei der Herstellung von Glas, Keramik, feuerfesten Materialien, Schleifmitteln und Wasserglas
-Verfärbung und Reinigung von Ölen und Erdölprodukten
-In Gießereiformen
-Als Antibackmittel für Pulver aller Art
-Als Entschäumer
-Zum Filtern von Flüssigkeiten wie Lösungsmitteln für die chemische Reinigung, Schwimmbadwasser sowie kommunalem und industriellem Abwasser
-Bei der Herstellung von Wärmeisolierungen, feuerhemmenden Ziegeln sowie feuer- und säurebeständigen Verpackungsmaterialien
-Als Füllstoff bei der Herstellung von Papier und Pappe, um sie widerstandsfähiger zu machen
-Als Farbfüller zur Verbesserung von Fließfähigkeit und Farbe
-In Materialien zum Polieren von Metallen und Holz, da es ihnen Abrasivität verleiht
-In Laboratorien für chemische Analyse in der Chromatographie und als Absorptionsmittel
-Als Antibackmittel in insektiziden und agrochemischen Formeln, zum Mahlen wachsartiger Pestizide und als Träger des Wirkstoffs
-Als Katalysatorträger
-Als Füllstoff zur Verstärkung von synthetischen Kautschuken und Kautschuken
-Als Flüssigkeitsträger in Tierfutter
-In Druckfarben
-Als Trockenmittel und Adsorbens in Form von Kieselgel
-Als Zusatz in Zement
-Wie Tierstreu
-In Isolatoren für die Mikroelektronik
-Bei thermooptischen Schaltern

In der Lebensmittelindustrie
Amorphes Siliciumdioxid wird in eine Vielzahl von Lebensmitteln als multifunktionaler direkter Bestandteil in verschiedenen Arten von Lebensmitteln eingearbeitet. Es sollte 2% des fertigen Lebensmittels nicht überschreiten.
Zum Beispiel dient es als Antibackmittel (um das Anhaften bestimmter Lebensmittel zu verhindern), als Stabilisator bei der Bierherstellung, als Fällungsschutzmittel, um Wein, Bier sowie Obst- oder Gemüsesäfte zu filtern.

Es wirkt als Absorptionsmittel für Flüssigkeiten in einigen Lebensmitteln und als Bestandteil von Mikrokapseln zum Würzen von Ölen.
Zusätzlich das SiOzwei Amorph wird durch ein spezielles Verfahren auf die Oberfläche der Kunststoffe von Lebensmittelverpackungsartikeln aufgebracht, das als Barriere wirkt.
In der pharmazeutischen Industrie
Es wird als Antiback-, Verdickungs-, Geliermittel und als Hilfsstoff, dh als Hilfsmittel zur Tablette verschiedener Medikamente und Vitamine, zugesetzt.
In der Kosmetik- und Körperpflegeindustrie
Es wird in einer Vielzahl von Produkten verwendet: in Gesichtspudern, Lidschatten, Eyeliner, Lippenstiften, Rouge, Make-up-Entfernern, Pudern, Fußpudern, Haarfärbemitteln und Bleichmitteln.
Auch in Ölen und Badesalzen, Schaumbädern, Hand- und Körpercremes, Feuchtigkeitscremes, Deodorants, Gesichtscremes oder Masken (außer Rasiercremes), Parfums, Lotionen und Reinigungscremes.
Auch in nächtlichen Feuchtigkeitscremes, Nagellacken und Glitzern, hauterfrischenden Lotionen, Haartonern, Zahnpasta, Haarspülungen, Bräunungsgelen und Cremes.
In therapeutischen Anwendungen
Das SiOzwei Es ist in bioaktiven Gläsern oder Biogläsern enthalten, deren Hauptmerkmal darin besteht, dass sie chemisch mit der sie umgebenden biologischen Umgebung reagieren und eine starke und dauerhafte Bindung mit lebendem Gewebe eingehen können.
Diese Art von Material wird verwendet, um Knochenersatzprodukte wie die im Gesicht als "Gerüste" herzustellen, auf denen Knochenzellen wachsen. Sie haben eine gute Biokompatibilität sowohl mit Knochen als auch mit Weichteilen gezeigt.
Mit dieser Bioglas können Menschen, die sie durch Unfall oder Krankheit verloren haben, Knochen des Gesichts zurückgewinnen.
Risiken
Sehr feine Silikapartikel können in die Luft gelangen und nicht explosive Stäube bilden. Dieser Staub kann jedoch Haut und Augen reizen. Einatmen führt zu Reizungen der Atemwege.
Darüber hinaus führt das Einatmen von Quarzstaub zu einer langfristig fortschreitenden Schädigung der Lunge, die als Silikose bezeichnet wird..
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Siliciumdioxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Da Silva, M.R. et al. (2017). Grüne Extraktionstechniken. Sorbentien auf Silica-Basis. In der umfassenden analytischen Chemie. Von sciencedirect.com wiederhergestellt.
- Ylänen, H. (Herausgeber). (2018). Bioaktive Gläser: Materialien, Eigenschaften und Anwendungen (2. Auflage). Elsevier. Von books.google.co.ve wiederhergestellt.
- Windholz, M. et al. (Herausgeber) (1983) The Merck Index. Eine Enzyklopädie der Chemikalien, Drogen und Biologika. Zehnte Ausgabe. Merck & CO., Inc..
- Mäkinen, J. und Suni, T. (2015). Dickfilm-SOI-Wafer. Im Handbuch für silikonbasierte MEMS-Materialien und -Technologien (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Sirleto, L. et al. (2010). Thermooptische Schalter. Silizium-Nanokristalle. Von sciencedirect.com wiederhergestellt.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.