
Zinkoxid (ZnO) -Struktur, Eigenschaften, Verwendungen, Risiken

Das Zinkoxid Es ist eine anorganische Verbindung, deren chemische Formel ZnO ist. Es besteht ausschließlich aus Zn-Ionenzwei+ michzwei- im Verhältnis 1: 1; sein kristallines Gitter kann jedoch eine Lücke von O aufweisenzwei-, Dies führt zu strukturellen Defekten, die die Farben Ihrer synthetischen Kristalle verändern können.
Es wird kommerziell als pulverförmiger weißer Feststoff (unteres Bild) erworben, der direkt aus der Oxidation von metallischem Zink nach dem französischen Verfahren hergestellt wird. oder Zinkerze einer carbothermischen Reduktion aussetzen, so dass ihre Dämpfe dann oxidiert werden und sich verfestigen.

Andere Verfahren zur Herstellung von ZnO bestehen darin, sein Hydroxid Zn (OH) auszufällen.zwei, aus wässrigen Lösungen von Zinksalzen. Ebenso können morphologisch variierte Dünnfilme oder Nanopartikel aus ZnO unter Verwendung ausgefeilterer Techniken wie der chemischen Abscheidung seiner Dämpfe synthetisiert werden..
Dieses Metalloxid kommt in der Natur als Mineral Zinkit vor, dessen Kristalle aufgrund metallischer Verunreinigungen üblicherweise gelb oder orange sind. ZnO-Kristalle zeichnen sich dadurch aus, dass sie piezoelektrisch, thermochrom, lumineszierend, polar sind und auch ein sehr breites Energieband in ihren Halbleitereigenschaften aufweisen.
Strukturell ist es isomorph zu Zinksulfid, ZnS, und nimmt hexagonale und kubische Kristalle an, die denen von Wurzit bzw. Blende ähnlich sind. In diesen gibt es einen gewissen kovalenten Charakter in den Wechselwirkungen zwischen Znzwei+ michzwei-, Dies führt zu einer heterogenen Ladungsverteilung im ZnO-Kristall.
Studien zu den Eigenschaften und Verwendungen von ZnO erstrecken sich auf die Bereiche Physik, Elektronik und Biomedizin. Die einfachste und alltäglichste Anwendung bleibt bei der Zusammensetzung von Gesichtscremes und Körperpflegeprodukten sowie bei Sonnenschutzmitteln unbemerkt.
Artikelverzeichnis
- 1 Struktur
- 1.1 Polymorphe
- 1.2 Wechselwirkungen
- 1.3 Morphologie von Nanopartikeln
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Schmelzpunkt
- 2.4 Dichte
- 2.5 Löslichkeit in Wasser
- 2.6 Amphoterismus
- 2.7 Wärmekapazität
- 2.8 Direkte Energielücke
- 3 Verwendungen
- 3.1 Medizin
- 3.2 Antibakteriell
- 3.3 Pigmente und Beschichtungen
- 3.4 Biobilder
- 3.5 Additiv
- 3.6 Schwefelwasserstofffänger
- 4 Risiken
- 5 Referenzen
Struktur
Polymorphe
ZnO kristallisiert unter normalen Druck- und Temperaturbedingungen in einer hexagonalen Wurzitstruktur. In dieser Struktur sind die Zn-Ionenzwei+ michzwei- sind in abwechselnden Schichten so angeordnet, dass jede von einem Tetraeder mit ZnO umgeben ist4 oder OZn4, beziehungsweise.
Unter Verwendung einer "Schablone" oder eines kubischen Trägers kann das ZnO auch dazu gebracht werden, zu einer kubischen Struktur aus Zinkblende zu kristallisieren; die wie Wurzit isomorphen Strukturen (räumlich identisch, aber mit unterschiedlichen Ionen) von Zinksulfid, ZnS, entsprechen.
Zusätzlich zu diesen beiden Strukturen (Wurzit und Blende) kristallisiert ZnO unter hohem Druck (etwa 10 GPa) in der Steinsalzstruktur, genau wie NaCl.
Interaktionen
Wechselwirkungen zwischen Znzwei+ michzwei- weisen einen bestimmten Charakter der Kovalenz auf, so dass teilweise eine kovalente Zn-O-Bindung besteht (beide Atome mit sp-Hybridisierung3) und aufgrund der Verzerrung der Tetraeder manifestieren sie ein Dipolmoment, das die Ionenanziehung der ZnO-Kristalle erhöht.
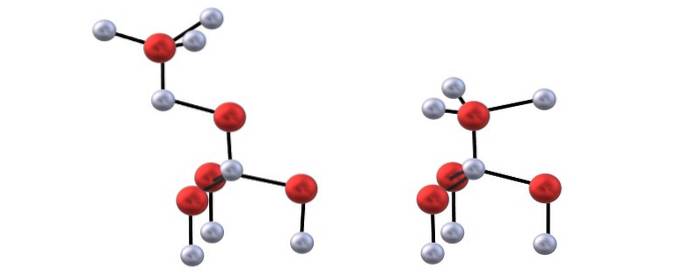
Sie haben das obere Bild, um die für die ZnO-Strukturen erwähnten Tetraeder zu visualisieren.
Der Unterschied zwischen der Blenda- und der Wurzitstruktur liegt auch in der Tatsache, dass die Ionen von oben gesehen nicht verdunkelt werden. Beispielsweise wird bei Wurzit erkannt, dass die weißen Kugeln (Znzwei+) befinden sich direkt über den roten Kugeln (O.zwei-). Andererseits geschieht dies in der kubischen Struktur der Mischung nicht, weil es drei Schichten gibt: A, B und C anstelle von nur zwei.
Nanopartikelmorphologie
Obwohl ZnO-Kristalle dazu neigen, hexagonale Wurzitstrukturen zu haben, ist die Morphologie ihrer Nanopartikel eine andere Geschichte. Abhängig von den Parametern und Synthesemethoden können diese so unterschiedliche Formen annehmen, wie z. B. Stäbchen, Platten, Blätter, Kugeln, Blüten, Gürtel, Nadeln..
Eigenschaften
Aussehen
Weißer, geruchloser, pudriger Feststoff mit bitterem Geschmack. In der Natur kann es kristallisiert mit metallischen Verunreinigungen wie Zinkitmineral gefunden werden. Wenn solche Kristalle weiß sind, zeigen sie Thermochromie, was bedeutet, dass sie beim Erhitzen ihre Farbe ändern: von weiß nach gelb..
Ebenso können seine synthetischen Kristalle abhängig von ihrer stöchiometrischen Sauerstoffzusammensetzung rötliche oder grünliche Farben aufweisen; das heißt, die Lücken oder Leerstellen, die durch das Fehlen von Anionen O verursacht werdenzwei- wirkt sich direkt auf die Art und Weise aus, wie Licht mit ionischen Netzwerken interagiert.
Molmasse
81,406 g / mol
Schmelzpunkt
1974 ° C. Bei dieser Temperatur wird es thermisch zersetzt, wobei Zinkdämpfe und molekularer oder gasförmiger Sauerstoff freigesetzt werden..
Dichte
5,1 g / cm3
Wasserlöslichkeit
ZnO ist in Wasser praktisch unlöslich und führt bei 18 ºC kaum zu Lösungen mit einer Konzentration von 0,0004%.
Amphoterismus
ZnO kann sowohl mit Säuren als auch mit Basen reagieren. Wenn es mit einer Säure in wässriger Lösung reagiert, erhöht sich seine Löslichkeit durch Bildung eines löslichen Salzes, in dem Zn enthalten istzwei+ Komplexierung mit Wassermolekülen: [Zn (OHzwei)6]]zwei+. Zum Beispiel reagiert es mit Schwefelsäure unter Bildung von Zinksulfat:
ZnO + H.zweiSW4 → ZnSO4 + H.zweiODER
In ähnlicher Weise reagiert es mit Fettsäuren unter Bildung ihrer jeweiligen Salze wie Zinkstearat und Palmitat..
Und wenn es in Gegenwart von Wasser mit einer Base reagiert, entstehen die Zinksalze:
ZnO + 2NaOH + H.zweiO → Nazwei[Zn (OH)4]]
Wärmekapazität
40,3 J / K mol
Direkte Energielücke
3.3 eV. Dieser Wert macht es zu einem Breitbandhalbleiter, der unter starken elektrischen Feldern arbeiten kann. Es hat auch die Eigenschaft, ein Halbleiter dieses Typs zu sein n, was nicht in der Lage war, die Gründe zu erklären, warum es einen zusätzlichen Beitrag von Elektronen in seiner Struktur gibt.
Dieses Oxid zeichnet sich durch seine optischen, akustischen und elektronischen Eigenschaften aus, dank derer es als Kandidat für mögliche Anwendungen im Zusammenhang mit der Entwicklung optoelektronischer Bauelemente (Sensoren, Laserdioden, Photovoltaikzellen) gilt. Der Grund für solche Eigenschaften liegt außerhalb des Bereichs der Physik.
Anwendungen
Medizinisch
Zinkoxid wurde als Additiv in zahlreichen weißen Cremes zur Behandlung von Reizungen, Aknen, Dermatitis, Schürfwunden und Hautrissen verwendet. In diesem Bereich ist seine Verwendung beliebt, um Reizungen durch Windeln auf der Haut von Babys zu lindern..
Es ist auch Bestandteil von Sonnenschutzmitteln, da zusammen mit den Nanopartikeln aus Titandioxid TiOzwei, Es hilft, die ultraviolette Strahlung der Sonne zu blockieren. Ebenso wirkt es als Verdickungsmittel, weshalb es in bestimmten Licht-Make-ups, Lotionen, Emails, Talkum und Seifen enthalten ist..
Andererseits ist ZnO eine Zinkquelle, die in Nahrungsergänzungsmitteln und Vitaminprodukten sowie in Getreide verwendet wird..
Antibakteriell
Entsprechend der Morphologie seiner Nanopartikel kann ZnO unter ultravioletter Strahlung aktiviert werden, um Wasserstoffperoxide oder reaktive Spezies zu erzeugen, die die Zellmembranen von Mikroorganismen schwächen.
In diesem Fall furchen die verbleibenden ZnO-Nanopartikel das Zytoplasma und beginnen mit dem Kompendium der Biomoleküle, aus denen die Zelle besteht, zu interagieren, was zu ihrer Apoptose führt..
Deshalb können nicht alle Nanopartikel in Sonnenschutzzusammensetzungen verwendet werden, sondern nur solche, denen die antibakterielle Aktivität fehlt..
Produkte mit dieser Art von ZnO wurden entwickelt und mit löslichen Polymermaterialien beschichtet, um Infektionen, Wunden, Geschwüre, Bakterien und sogar Diabetes zu behandeln..
Pigmente und Beschichtungen
Das als Weißzink bekannte Pigment ist ZnO, das verschiedenen Farben und Beschichtungen zugesetzt wird, um Metalloberflächen dort zu schützen, wo sie vor Korrosion aufgebracht werden. Beispielsweise werden Beschichtungen mit zugesetztem ZnO zum Schutz von verzinktem Eisen verwendet..
Andererseits wurden diese Beschichtungen auch auf Fensterglas verwendet, um zu verhindern, dass Wärme eindringt (wenn sie außen ist) oder eindringt (wenn sie innen ist). Ebenso schützt es einige polymere und textile Materialien vor einer Verschlechterung durch Sonneneinstrahlung und Wärme..
Bioimages
Die Lumineszenz von ZnO-Nanopartikeln wurde für die Verwendung in der Bioabbildung untersucht, wodurch die inneren Strukturen von Zellen durch das strahlende blaue, grüne oder orangefarbene Licht untersucht wurden..
Zusatzstoff
ZnO findet aufgrund seines niedrigeren Schmelzpunktes und seines Verhaltens als Flussmittel auch Verwendung als Additiv in Kautschuken, Zementen, Zahnputzmitteln, Gläsern und Keramiken..
Schwefelwasserstoff-Eliminator
ZnO entfernt unangenehme H-GasezweiJa, um einige Dämpfe zu entschwefeln:
ZnO + H.zweiS → ZnS + H.zweiODER
Risiken
Zinkoxid als solches ist eine ungiftige und harmlose Verbindung, so dass der umsichtige Umgang mit seinem Feststoff kein Risiko darstellt..
Das Problem liegt jedoch in seinem Rauch, denn obwohl er sich bei hohen Temperaturen zersetzt, kontaminieren die Zinkdämpfe die Lunge und verursachen eine Art „Metallfieber“. Diese Krankheit ist gekennzeichnet durch Symptome von Husten, Fieber, ein Gefühl der Engegefühl in der Brust und einen konstanten metallischen Geschmack im Mund..
Es ist auch nicht krebserregend, und es wurde nicht gezeigt, dass Cremes, die es enthalten, die Zinkaufnahme in die Haut erhöhen. Daher gelten Sonnenschutzmittel auf ZnO-Basis als sicher. es sei denn, es gibt allergische Reaktionen. In diesem Fall sollte die Verwendung eingestellt werden.
Bei bestimmten Nanopartikeln, die zur Bekämpfung von Bakterien entwickelt wurden, können diese negative Auswirkungen haben, wenn sie nicht korrekt zu ihrem Wirkort transportiert werden..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Zinkoxid. Wiederhergestellt von: en.wikipedia.org
- Hadis Morkoç und Ümit Özgur. (2009). Zinkoxid: Grundlagen, Materialien und Gerätetechnologie. [PDF]. Wiederhergestellt von: application.wiley-vch.de
- Parihar, M. Raja und R. Paulose. (2018). Ein kurzer Überblick über die strukturellen, elektrischen und elektrochemischen Eigenschaften von Zinkoxid-Nanopartikeln. [PDF]. Wiederhergestellt von: ipme.ru
- A. Rodnyi und I. V. Khodyuk. (2011). Optische und Lumineszenzeigenschaften von Zinkoxid. Wiederhergestellt von: arxiv.org
- K. S. Siddiqi, A. Ur Rahman, A. Tajuddin & A. Husen (2018). Eigenschaften von Zinkoxid-Nanopartikeln und ihre Aktivität gegen Mikroben. Nanoscale Research Letters, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- ChemicalSafetyFacts. (2019). Zinkoxid. Wiederhergestellt von: chemicsafetyfacts.org
- Jinhuan Jiang, Jiang Pi und Jiye Cai. (2018). Die Weiterentwicklung von Zinkoxid-Nanopartikeln für biomedizinische Anwendungen. Bioanorganische Chemie und Anwendungen, vol. 2018, Artikel-ID 1062562, 18 Seiten. doi.org/10.1155/2018/1062562



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.