
Struktur, Eigenschaften, Verwendungen, Risiken von Bariumoxid (BaO)

Das Bariumoxid Es ist ein anorganischer Feststoff, der aus einem Bariumatom (Ba) und einem Sauerstoffatom (O) besteht. Seine chemische Formel lautet BaO. Es ist ein weißer kristalliner Feststoff und hygroskopisch, dh es nimmt Feuchtigkeit aus der Luft auf, reagiert dabei aber damit..
Durch die schnelle Reaktion von Bariumoxid mit Wasser wird es in Laboratorien für chemische Analysen zum Austrocknen verwendet, dh zum Entfernen von Wasser aus organischen Lösungsmitteln, bei denen es sich um flüssige Verbindungen handelt, die zum Auflösen anderer Substanzen dienen..

BaO verhält sich wie eine starke Base und reagiert daher mit vielen Arten von Säuren. Zum Beispiel reagiert leicht mit Kohlendioxid COzwei aus der Luft unter Bildung von Bariumcarbonat BaCO3.
Es wird bei der Herstellung von Polymeren für Stromkabel und als Bestandteil für Harze verwendet, um Löcher in ausgehärteten Zähnen abzudichten.
Bariumoxid (BaO) wird auch in der Keramikindustrie verwendet, sowohl zur Beschichtung mit Glasur als auch zur Herstellung. Es wird auch in Zementmischungen verwendet, um die Druckfestigkeit des Endprodukts zu erhöhen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 4 Chemische Eigenschaften
- 5 Risiken
- 6 Erhalten
- 7 Verwendungen
- 7.1 Als Trockenmittel für organische Lösungsmittel
- 7.2 In Entladungslampen
- 7.3 Bei der Herstellung von Keramik
- 7.4 Bei der Herstellung von Zementmischungen
- 7.5 In verschiedenen Anwendungen
- 8 Referenzen
Struktur
Bariumoxid-BaO besteht aus einem Ba-Kationzwei+ und ein Sauerstoffanion O.zwei-.
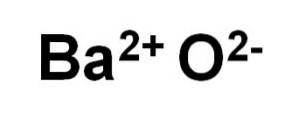
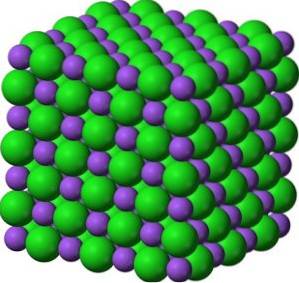
BaO bildet in seinen Kristallen kubische ionische Netzwerke (würfelförmig) vom Natriumchlorid-Typ.
Die Elektronenkonfiguration des Bariumions ist: [Xe] 6s0 wie es die beiden Elektronen der 6s-Schale verloren hat. Diese Konfiguration ist sehr stabil.
Nomenklatur
-Bariumoxid
-Bariummonoxid
Physikalische Eigenschaften
Körperlicher Status
Gelblich-weißer kristalliner Feststoff.
Molekulargewicht
153,33 g / mol
Schmelzpunkt
1923 ºC
Siedepunkt
Ungefähr 2000 ºC.
Dichte
5,72 g / cm3
Löslichkeit
In Wasser schwer löslich: 3,8 g / 100 ml bei 20 ºC.
Chemische Eigenschaften
Bariumoxid BaO reagiert schnell mit Wasser, gibt Wärme ab und bildet eine ätzende Lösung von Bariumhydroxid Ba (OH)zwei, Dies ist das löslichste Hydroxid unter den Erdalkalimetallhydroxiden.
BaO + H.zweiO → Ba (OH)zwei
BaO ist eine starke Basis. Reagiert exotherm (d. H. Unter Wärmeentwicklung) mit allen Arten von Säuren.
Mit COzwei BaO reagiert unter Bildung von Bariumcarbonat BaCO3.
BaO + COzwei → BaCO3
BaO ist hygroskopisch. Wenn es der Umwelt ausgesetzt wird, verbindet es sich nach und nach mit der Luftfeuchtigkeit und bildet Ba (OH).zwei welches sich mit Kohlendioxid CO verbindetzwei aus der Luft zu Bariumcarbonat BaCO3.
Wenn Bariummonoxid BaO in Gegenwart von Luft erhitzt wird, verbindet es sich mit Sauerstoff, um Bariumperoxid BaO zu bildenzwei. Die Reaktion ist reversibel.
2 BaO + O.zwei Ba 2 BaOzwei
In Gegenwart von Wasser kann es mit Aluminium Al oder Zink Zn reagieren, die Oxide oder Hydroxide der Metalle bilden und Wasserstoffgas H erzeugenzwei.
Kann die Polymerisation von polymerisierbaren organischen Verbindungen wie Epoxiden initiieren.
Risiken
Kann beim Verschlucken giftig sein. Es sollte nicht mit der Haut in Kontakt kommen. Es reizt Augen, Haut und Atemwege. Es kann schädlich für das Nervensystem sein. Es ist in der Lage, niedrige Kaliumspiegel zu verursachen, was zu Herz- und Muskelstörungen führt.
Erhalten
Bariumoxid-BaO kann durch Erhitzen von Bariumcarbonat-BaCO erhalten werden3 mit Holzkohle. BaO wird gebildet und Kohlenmonoxidgas CO wird freigesetzt.
Bacchus3 + C → BaO + 2 CO ↑
Anwendungen
Als Trockenmittel für organische Lösungsmittel
Aufgrund seiner leichten Reaktion mit Wasser wird BaO seit Mitte des letzten Jahrhunderts als Trockenmittel für Benzin und basische oder neutrale organische Lösungsmittel verwendet..
BaO trocknet sehr aktiv um es herum, es nimmt sehr schnell Feuchtigkeit auf, wobei sich ziemlich viel Wärme entwickelt und Bariumhydroxid Ba (OH) gebildet wird.zwei das ist stabil bis ca. 1000 ºC. Aus diesem Grund kann BaO bei hohen Temperaturen eingesetzt werden..
Es hat auch ein hohes Wasseraufnahmevermögen. Für jedes BaO-Molekül können eines der Wasser und das Ba (OH) absorbiert werdenzwei Das Ergebnis kann auch eine bestimmte Menge Wasser absorbieren.
Es ist für Laboratorien für analytische Chemie geeignet. Nicht klebrig.
Es kann in Exsikkatoren verwendet werden, bei denen es sich um große Glasbehälter mit einem Deckel handelt, in denen die innere Umgebung trocken gehalten wird. BaO hält die Miniaturatmosphäre des Exsikkators trocken.

Diese Exsikkatoren dienen zum Einbringen von Substanzen oder Reagenzien und verhindern so, dass diese Wasser aus der Umwelt aufnehmen.
Es wird auch zum Trocknen von basischen Gasen wie NH-Ammoniak verwendet.3.
In Entladungslampen
BaO wird als elektronenemittierendes Material auf die Elektroden von Entladungslampen aufgebracht.
Entladungslampen bestehen aus einer Röhre aus Glas, Quarz oder einem anderen geeigneten Material und enthalten ein Inertgas und in den meisten Fällen einen Metalldampf. Metallischer Dampf kann Natrium oder Quecksilber sein.

Elektrische Entladungen treten innerhalb der Röhre auf, weil sie eine positive und eine negative Elektrode hat.
Das BaO wird auf die Elektroden der Lampe gelegt. Die Elektronen, die es emittiert, kollidieren mit den Atomen des Metalldampfes und übertragen Energie auf sie..
Wenn ein elektrischer Strom durch dieses Gas oder diesen Dampf fließt, wird sichtbares Licht oder ultraviolette (UV) Strahlung erzeugt..
Bei der Herstellung von Keramik
BaO wird in Keramikglasurbeschichtungszusammensetzungen verwendet.

Es wurde jedoch auch als Additiv bei der Herstellung von Glaskeramik getestet.
BaO verbessert effektiv die mechanischen Eigenschaften und die chemische Beständigkeit dieser Art von Keramik. Es hat einen starken Einfluss auf die thermischen Eigenschaften und die Zusammensetzung der kristallinen Phase der erhaltenen Materialien..
Bei der Herstellung von Zementmischungen
BaO wurde als Bestandteil von Phosphoaluminatzement getestet.
Diese Art von Zement ist in Meeresumgebungen nützlich, da sie nicht die gleiche Tendenz zur Hydratation aufweist wie andere Zementsorten, so dass sie nicht unter Porenbildung oder -ausdehnung leidet..
Phosphoaluminatzemente müssen jedoch in ihrer mechanischen Leistung verstärkt werden, um Meeresströmungen und Schlägen von schwimmenden Eisstücken im Ozean standzuhalten..
Die Zugabe von BaO zum Phosphoaluminat-Zement verändert die Mineralstruktur des Materials, verbessert die Porenstruktur und erhöht die Druckfestigkeit der Zementpaste erheblich..
Mit anderen Worten, BaO verbessert die Druckfestigkeit dieser Art von Zement..

In verschiedenen Anwendungen
Es wird als Zutat verwendet, um in Zahnharzen Opazität zum Füllen von Löchern in Zähnen bereitzustellen, die von Zahnärzten durchgeführt werden.
Es wird auch als Keimbildner zur Herstellung von Polyvinylidenfluoridpolymeren verwendet, die zur Isolierung von Stromkabeln verwendet werden..
Verweise
- Partyka, J. et al. (2016). Einfluss der Zugabe von BaO auf das Sintern von Glaskeramikmaterialien aus SiOzwei-ZumzweiODER3-N / AzweiIN ORDNUNGzweiO-CaO / MgO-System. J Therm Anal Calorim (2016) 125: 1095. Von link.springer.com wiederhergestellt.
- Zhang, P. et al. (2019). Einfluss von BaO auf die Mineralstruktur und das Hydratationsverhalten von Phosphoaluminatzement. J Therm Anal Calorim (2019) 136: 2319. Von link.springer.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Bariumoxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Smith, N.A. (2003). Beleuchtung. Prinzip. Im Nachschlagewerk für Elektrotechniker (16. Ausgabe). Von sciencedirect.com wiederhergestellt.
- Ebnesajjad, S. (2003). Fluorpolymerschäume. Schäumendes PVDF. In schmelzverarbeitbaren Fluorkunststoffen. Von sciencedirect.com wiederhergestellt.
- Booth, H.S. und McIntyre, L.H. (1930). Bariumoxid als Trockenmittel. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Von pubs.acs.org wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.