
Charakteristische Topoisomerasen, Funktionen, Typen und Inhibitoren
Das Topoisomerasen Sie sind eine Art von Isomeraseenzymen, die die Topologie der Desoxyribonukleinsäure (DNA) modifizieren und sowohl ihre Abwicklung als auch ihre Wicklung und Superwicklung erzeugen.
Diese Enzyme spielen eine spezifische Rolle beim Abbau von Torsionsstress in der DNA, so dass wichtige Prozesse wie Replikation, Transkription von DNA in Messenger-Ribonukleinsäure (mRNA) und Rekombination von DNA stattfinden können..
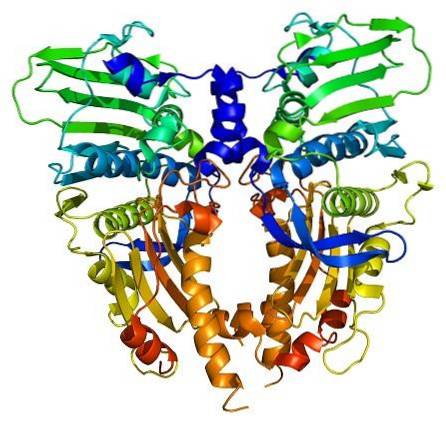
Topoisomeraseenzyme sind sowohl in eukaryotischen als auch in prokaryotischen Zellen vorhanden. Seine Existenz wurde von den Wissenschaftlern Watson und Crick vorhergesagt, als sie die Einschränkungen bewerteten, die die Struktur der DNA aufwies, um den Zugang zu ihren Informationen zu ermöglichen (gespeichert in ihrer Nukleotidsequenz)..
Um die Funktionen von Topoisomerasen zu verstehen, muss angenommen werden, dass DNA eine stabile Doppelhelixstruktur aufweist, deren Stränge übereinander gewickelt sind..
Diese linearen Ketten bestehen aus 2-Desoxyribose, die durch 5'-3'-Phosphodiesterbindungen verbunden ist, und stickstoffhaltigen Basen darin, wie die Sprossen einer Wendeltreppe..
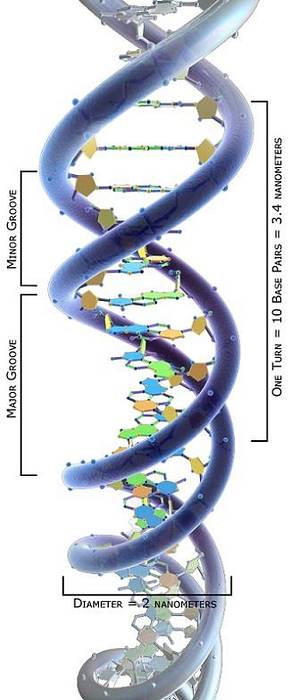
Die topologische Untersuchung von DNA-Molekülen hat gezeigt, dass sie abhängig von ihrer Torsionsspannung verschiedene Konformationen annehmen können: von einem entspannten Zustand zu verschiedenen Wickelzuständen, die ihre Verdichtung ermöglichen..
DNA-Moleküle mit unterschiedlichen Konformationen werden als Topoisomere bezeichnet. Wir können daher den Schluss ziehen, dass die Topoisomerasen I und II die Torsionsspannung von DNA-Molekülen erhöhen oder verringern und ihre verschiedenen Topoisomere bilden können..
Unter den möglichen DNA-Topoisomeren ist die häufigste Konformation die Superspule, die sehr kompakt ist. Die DNA-Doppelhelix muss jedoch auch bei verschiedenen molekularen Prozessen durch Topoisomerasen abgewickelt werden..
Artikelverzeichnis
- 1 Funktionen
- 1.1 Allgemeiner Wirkungsmechanismus
- 1.2 Topoisomerasen und der Zellzyklus
- 2 Funktionen
- 2.1 Kompakte Lagerung von genetischem Material
- 2.2 Zugang zu genetischer Information
- 2.3 Regulation der Genexpression
- 2.4 Besonderheiten der Topoisomerase II
- 3 Arten von Topoisomerasen
- 3.1 -Topoisomerasen Typ I.
- 3.2 -Topoisomerasen Typ II
- 3.3 -Human-Topoisomerasen
- 4 Topoisomerase-Inhibitoren
- 4.1 -Topoisomerasen als Ziel eines chemischen Angriffs
- 4.2 -Typen der Hemmung
- 4.3 - Topoisomerase-Inhibitoren
- 5 Referenzen
Eigenschaften
Allgemeiner Wirkmechanismus
Einige Topoisomerasen können nur negative DNA-Superspulen oder beide DNA-Superspulen entspannen: positiv und negativ.
Wenn die kreisförmige doppelsträngige DNA auf ihrer Längsachse abgewickelt wird und eine Linkskurve (im Uhrzeigersinn) auftritt, spricht man von einer negativen Superwicklung. Wenn die Drehung im Uhrzeigersinn (gegen den Uhrzeigersinn) erfolgt, ist sie positiv überrollt.

Grundsätzlich können Topoisomerasen:
-Erleichterung des Durchgangs eines DNA-Strangs durch einen Schnitt im gegenüberliegenden Strang (Typ I-Topoisomerase).
-Erleichterung des Durchgangs einer vollständigen Doppelhelix durch eine Spaltung selbst oder durch eine Spaltung in eine andere Doppelhelix (Typ II-Topoisomerase).
Zusammenfassend lässt sich sagen, dass Topoisomerasen durch die Spaltung von Phosphodiesterbindungen in einem oder beiden Strängen, aus denen sich die DNA zusammensetzt, wirken. Dann modifizieren sie den Wicklungszustand der Stränge einer Doppelhelix (Topoisomerase I) oder zweier Doppelhelices (Topoisomerase II), um die gespaltenen Enden schließlich wieder zu binden oder zu binden.
Topoisomerasen und der Zellzyklus
Obwohl Topoisomerase I ein Enzym ist, das während der S-Phase (DNA-Synthese) eine größere Aktivität zeigt, wird nicht angenommen, dass es von einer Phase des Zellzyklus abhängt.
Während die Topoisomerase II-Aktivität während der logarithmischen Phase des Zellwachstums und in Zellen schnell wachsender Tumoren am aktivsten ist.
Eigenschaften
Die Veränderung der Gene, die für Topoisomerasen kodieren, ist für Zellen tödlich, was die Bedeutung dieser Enzyme belegt. Zu den Prozessen, an denen Topoisomerasen beteiligt sind, gehören:
Kompakte Lagerung von genetischem Material
Topoisomerasen erleichtern die Speicherung genetischer Informationen auf kompakte Weise, da sie das Auf- und Abwickeln von DNA erzeugen und es ermöglichen, eine große Menge an Informationen in einem relativ kleinen Volumen zu finden.
Zugang zu genetischer Information
Ohne Topoisomerasen und ihre einzigartigen Eigenschaften wäre der Zugang zu den in der DNA gespeicherten Informationen nicht möglich. Dies ist auf die Tatsache zurückzuführen, dass Topoisomerasen periodisch die Torsionsspannung freisetzen, die in der DNA-Doppelhelix während ihres Abwickelns bei den Prozessen der Replikation, Transkription und Rekombination erzeugt wird..
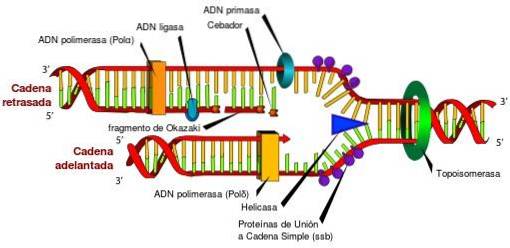
Wenn der während dieser Prozesse erzeugte Torsionsstress nicht freigesetzt wird, kann eine fehlerhafte Genexpression auftreten, die die zirkuläre DNA oder das Chromosom unterbricht und sogar zum Zelltod führt.
Regulation der Genexpression
Konformationsänderungen (in der dreidimensionalen Struktur) des DNA-Moleküls setzen bestimmte Regionen nach außen frei, die mit DNA-bindenden Proteinen interagieren können. Diese Proteine haben eine regulatorische Funktion der Genexpression (positiv oder negativ).
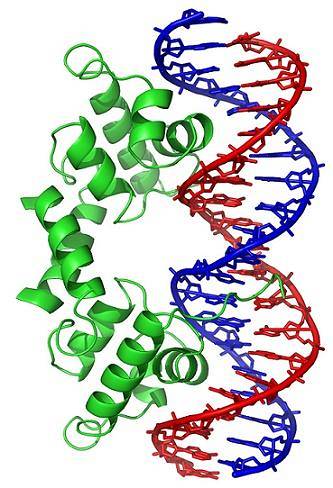
Somit beeinflusst der Wickelzustand der DNA, der durch die Wirkung von Topoisomerasen erzeugt wird, die Regulation der Genexpression.
Besonderheiten der Topoisomerase II
Topoisomerase II ist notwendig für den Aufbau von Chromatiden, die Kondensation und Dekondensation von Chromosomen und die Segregation von Tochter-DNA-Molekülen während der Mitose..
Dieses Enzym ist auch ein Strukturprotein und einer der Hauptbestandteile der Zellkernmatrix während der Interphase..
Arten von Topoisomerasen
Es gibt zwei Haupttypen von Topoisomerasen, je nachdem, ob sie einen oder zwei DNA-Stränge spalten können.
-Typ I-Topoisomerasen
Monomer
Typ I-Topoisomerasen sind Monomere, die negative und positive Superspulen lindern, die durch Haarnadelbewegung während der Transkription sowie während der Genreplikation und der Rekombinationsprozesse erzeugt werden..
Topoisomerasen vom Typ I können in Typ 1A und Typ 1B unterteilt werden. Letztere sind diejenigen, die beim Menschen vorkommen und für die Entspannung der supergewickelten DNA verantwortlich sind.
Tyrosin in seiner aktiven Stelle
Topoisomerase 1B (Top1B) besteht aus 765 Aminosäuren, die in 4 spezifische Domänen unterteilt sind. Eine dieser Domänen hat einen hochkonservierten Bereich, der das aktive Tyrosin-Zentrum enthält (Tyr7233). Alle Topoisomerasen enthalten in ihrem aktiven Zentrum ein Tyrosin, das eine grundlegende Rolle im gesamten katalytischen Prozess spielt.
Wirkmechanismus
Das Tyrosin des aktiven Zentrums bildet eine kovalente Bindung mit dem 3'-Phosphatende des DNA-Strangs, schneidet es und hält es an das Enzym gebunden, während ein weiterer DNA-Strang durch die Spaltung geleitet wird.
Der Durchgang des anderen DNA-Strangs durch den gespaltenen Strang wird durch eine Konformationstransformation des Enzyms erreicht, die die Öffnung der DNA-Doppelhelix erzeugt..
Dann kehrt die Topoisomerase I zu ihrer ursprünglichen Konformation zurück und bindet die gespaltenen Enden wieder. Dies geschieht durch einen Prozess, der umgekehrt zum Abbau der DNA-Kette an der katalytischen Stelle des Enzyms erfolgt. Schließlich setzt Topoisomerase den DNA-Strang frei.
Die Geschwindigkeit der DNA-Ligation ist höher als die Geschwindigkeit der Exzision, wodurch die Stabilität des Moleküls und die Integrität des Genoms sichergestellt werden..
Zusammenfassend katalysiert Topoisomerase vom Typ I:
- Die Spaltung eines Strangs.
- Der Durchgang des anderen Strangs durch die Spaltung.
- Ligation der gespaltenen Enden.
-Topoisomerasen vom Typ II
Dimer
Typ-II-Topoisomerasen sind dimere Enzyme, die beide DNA-Stränge spalten und so die Superspulen entspannen, die während der Transkription und anderer zellulärer Prozesse erzeugt werden.
Mg abhängig++ und ATP
Diese Enzyme benötigen Magnesium (Mg++) und benötigen auch die Energie, die aus dem Abbau der ATP-Triphosphat-Bindung stammt, die sie dank einer ATPase nutzen.
Zwei aktive Stellen mit Tyrosin
Humane Topoisomerasen II sind denen von Hefe sehr ähnlich (Saccharomyces cerevisiae), das aus zwei Monomeren besteht (Unterfragmente A und B). Jedes Monomer hat eine ATPase-Domäne und in einem Unterfragment das Tyrosin 782 des aktiven Zentrums, an das DNA binden kann. Somit können zwei DNA-Stränge an Topoisomerase II binden..
Wirkmechanismus
Der Wirkungsmechanismus von Topoisomerase II ist der gleiche wie der für Topoisomerase I beschriebene, wenn man bedenkt, dass zwei DNA-Stränge gespalten sind und nicht nur einer..
Am aktiven Zentrum der Topoisomerase II befindet sich ein Fragment von Doppelhelix von DNA, genannt "Fragment G". Dieses Fragment wird herausgeschnitten und durch kovalente Bindungen am aktiven Zentrum zusammengehalten..
Dann lässt das Enzym dank einer Konformationsänderung des Enzyms, die von der Hydrolyse von ATP abhängt, ein anderes DNA-Fragment, das als "T-Fragment" bezeichnet wird, durch das gespaltene Fragment "G" passieren.
Topoisomerase II bindet die beiden Enden des "G-Fragments" und stellt schließlich seinen Anfangszustand wieder her, wobei das "G" -Fragment freigesetzt wird. Die DNA entspannt dann den Torsionsstress, wodurch die Replikations- und Transkriptionsprozesse stattfinden können..
-Humane Topoisomerasen
Das menschliche Genom hat fünf Topoisomerasen: top1, top3α, top3β (vom Typ I); und top2α, top2β (vom Typ II). Die relevantesten menschlichen Topoisomerasen sind top1 (Typ IB-Topoisomerase) und 2α (Typ II-Topoisomerase)..
Topoisomerase-Inhibitoren
-Topoisomerasen als Ziel für chemische Angriffe
Da die durch Topoisomerasen katalysierten Prozesse für das Überleben von Zellen notwendig sind, sind diese Enzyme ein gutes Angriffsziel, um bösartige Zellen zu beeinflussen. Aus diesem Grund werden Topoisomerasen bei der Behandlung vieler menschlicher Krankheiten als wichtig angesehen..
Arzneimittel, die mit Topoisomerasen interagieren, werden derzeit umfassend als chemotherapeutische Substanzen gegen Krebszellen (in verschiedenen Organen des Körpers) und pathogene Mikroorganismen untersucht..
-Arten der Hemmung
Arzneimittel, die die Topoisomeraseaktivität hemmen, können:
- Eingeklemmt in DNA.
- Beeinflussen das Enzym Topoisomerase.
- Interkalieren Sie in einem Molekül nahe dem aktiven Zentrum des Enzyms, während der DNA-Topoisomerase-Komplex stabilisiert wird.
Die Stabilisierung des transienten Komplexes, der durch die Bindung von DNA an das Tyrosin der katalytischen Stelle des Enzyms gebildet wird, verhindert die Bindung der gespaltenen Fragmente, was zum Zelltod führen kann.
-Topoisomerase-Inhibitor-Medikamente
Verbindungen, die Topoisomerasen hemmen, umfassen die folgenden.
Antitumor-Antibiotika
Antibiotika werden gegen Krebs eingesetzt, da sie das Wachstum von Tumorzellen verhindern, normalerweise durch Störung ihrer DNA. Diese werden oft als antineoplastische (Krebs-) Antibiotika bezeichnet. Actinomycin D beeinflusst beispielsweise Topoisomerase II und wird bei Wilms-Tumoren bei Kindern und Rhabdomyosarkomen eingesetzt.
Anthracycline
Anthracycline gehören zu den Antibiotika, eines der wirksamsten Krebsmedikamente und mit dem breitesten Spektrum. Sie werden zur Behandlung von Lungen-, Eierstock-, Gebärmutter-, Magen-, Blasen-, Brust-, Leukämie- und Lymphomkrebs eingesetzt. Es ist bekannt, Topoisomerase II durch Interkalation in DNA zu beeinflussen.
Das erste aus einer Actinobakterie isolierte Anthracyclin (Streptomyces peucetius) war Daunorubicin. Später wurde Doxorubicin im Labor synthetisiert, und derzeit werden auch Epirubicin und Idarubicin verwendet.
Anthrachinone
Anthrachinone oder Anthracendione sind von Anthracen abgeleitete Verbindungen, ähnlich wie Anthracycline, die die Topoisomerase II-Aktivität durch Interkalation in DNA beeinflussen. Sie werden bei metastasierendem Brustkrebs, Non-Hodgkin-Lymphom (NHL) und Leukämie eingesetzt..
Diese Medikamente wurden in den Pigmenten einiger Insekten, Pflanzen (Frangula, Senna, Rhabarber), Flechten und Pilzen gefunden; sowie Hoelit, das ein natürliches Mineral ist. Abhängig von Ihrer Dosis können sie krebserregend sein.
Unter diesen Verbindungen haben wir Mitoxantron und sein Analogon Losoxantron. Diese verhindern die Proliferation von malignen Tumorzellen, die irreversibel an DNA binden.
Epidophyllotoxine
Podophyllotoxine wie Epidophyllotoxine (VP-16) und Teniposid (VM-26) bilden mit Topoisomerase II einen Komplex. Sie werden unter anderem gegen Lungenkrebs, Hodenkrebs, Leukämie, Lymphome, Eierstockkrebs, Brustkrebs und bösartige intrakranielle Tumoren eingesetzt. Sie sind aus Pflanzen isoliert Podophyllum notatum Y. P. peltatum.
Camptothecin-Analoga
Campothecine sind Verbindungen, die Topoisomerase I hemmen, einschließlich Irinotecan, Topotecan und Diflomotecan..
Diese Verbindungen wurden gegen Dickdarm-, Lungen- und Brustkrebs eingesetzt und werden auf natürliche Weise aus der Rinde und den Blättern der Baumarten gewonnen. Camptotheca acuminata der chinesischen Hornhäute und Tibet.
Natürliche Hemmung
Strukturelle Veränderungen der Topoisomerasen I und II können ebenfalls ganz natürlich auftreten. Dies kann bei einigen Ereignissen auftreten, die Ihren katalytischen Prozess beeinflussen.
Diese Veränderungen umfassen die Bildung von Pyrimidindimeren, Fehlpaarungen der Stickstoffbasen und andere Ereignisse, die durch oxidativen Stress verursacht werden..
Verweise
- Anderson, H. & Roberge, M. (1992). DNA-Topoisomerase II: Ein Überblick über ihre Beteiligung an Chromosomenstruktur, DNA-Replikation, Transkription und Mitose. Cell Biology International Reports, 16 (8): 717 & ndash; 724. doi: 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N. & Salgia, R. (2006). Eine Überprüfung der Topoisomerase-Hemmung bei Lungenkrebs. Cancer Biology & Therapy, 5 (12): 1600 & ndash; 1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S.C.F. & To, K.K.W. (2003). Antikrebsmittel auf Platinbasis: Innovative Designstrategien und biologische Perspektiven. Medicinal Research Reviews, 23 (5): 633 & ndash; 655. doi: 10.1002 / med.10038
- Li, T.-K. & Liu, L. F. (2001). Tumorzelltod durch Topoisomerase-Targeting-Medikamente. Jahresrückblick auf Pharmakologie und Toxikologie, 41 (1): 53-77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Liu, L. F. (1994). DNA-Topoisomerasen: Topoisomerase-Targeting-Medikamente. Akademische Presse. S. 307
- Osheroff, N. und Bjornsti, M. (2001). DNA-Topoisomerase. Enzymologie und Drogen. Vol. II. Humana Press. S. 329.
- Rothenberg, M. L. (1997). Topoisomerase I-Inhibitoren: Überprüfung und Aktualisierung. Annals of Oncology, 8 (9), 837 & ndash; 855. doi: 10.1023 / a: 1008270717294
- Ryan B. (2009, 14. Dezember). Topoisomerase 1 und 2. [Videodatei]. Von youtube.com wiederhergestellt

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.