
Natriumthiosulfat (Na2S2O3) Formel, Eigenschaften und Verwendungen
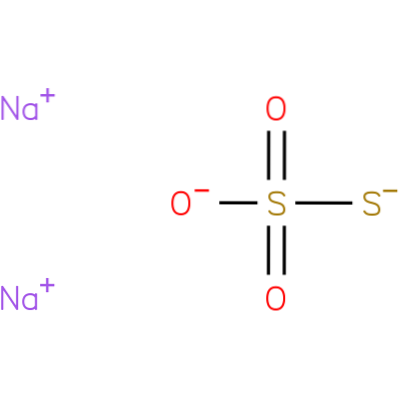
Das Natriumthiosulfat oder Natriumhyposulfit (NazweiS.zweiODER3) Es ist ein wichtiges anorganisches Salz mit verschiedenen medizinischen Anwendungen. Es ist auch als pentahydriertes Salz (Na) erhältlichzweiS.zweiODER3.5HzweiODER).
Es ist eine ionische Verbindung, die aus zwei Natriumkationen (Na) besteht+) und das negativ geladene Thiosulfatanion (S.zweiODER3-), bei dem das zentrale Schwefelatom über Einfach- und Doppelbindungen mit Resonanzcharakter an drei Sauerstoffatome und ein weiteres Schwefelatom (daher das Präfix Onkel) gebunden ist. Der Feststoff liegt in einer monoklinen Kristallstruktur vor.
Natriumthiosulfat kann durch Erhitzen von Schwefel mit einer wässrigen Lösung von Natriumsulfit oder einer wässrigen Lösung von Natriumhydroxid hergestellt werden..
6NaOH + 4S → NazweiS.zweiODER3 + 2NazweiS + 3HzweiODER
Es ist ein Medikament, das auf der Liste der wesentlichen Arzneimittel der Weltgesundheitsorganisation steht, den wirksamsten und sichersten Arzneimitteln, die in einem Gesundheitssystem benötigt werden (Natriumthiosulfat-Formel, S.F.)..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 3.1 Medizin
- 3.2 Iodometrie
- 3.3 Entchlorung von Wasser
- 3.4 Goldabbau
- 4 Referenzen
Physikalische und chemische Eigenschaften
Natriumthiosulfat hat ein Molekulargewicht von 158,11 g / mol für seine wasserfreie Form und 248,18 g / mol für die Pentahydratform. Darüber hinaus hat es eine Dichte von 1.667 g / ml (Nationales Zentrum für Biotechnologie-Informationen., 2017).
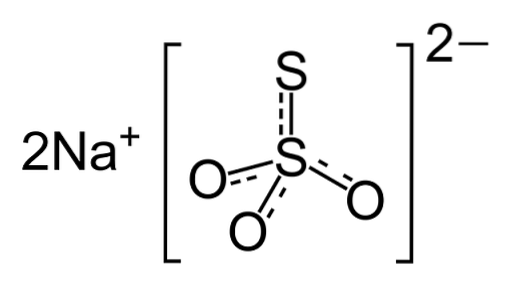
Natriumthiosulfat sind farblose monokline Kristalle ohne charakteristisches Aroma. Der Feststoff ist ausblühend, was bedeutet, dass er durch Verlust von Kristallwasser an der Luft selbst zu Staub zersetzt werden kann. Sein Aussehen ist in Abbildung 2 dargestellt.

Die Verbindung hat einen Schmelzpunkt von 48 ° C für die Pentahydratform und beginnt sich ab 100 ° C zu zersetzen. Dann einzweiS.zweiODER3 Es ist in Wasser sehr gut löslich und kann 70 Gramm pro 100 Milliliter Lösungsmittel lösen. Die Verbindung ist in Ethanol praktisch unlöslich (Royal Society of Chemistry, 2015).
Natriumthiosulfat ist ein neutrales Salz, das sich leicht in Wasser unter Bildung von Natrium- und Thiosulfationen dissoziiert. N / AzweiS.zweiODER3 Es ist unter normalen Bedingungen ein stabiler Feststoff, zersetzt sich jedoch beim Erhitzen unter Bildung von Natriumsulfat und Natriumpolysulfid:
4NazweiS.zweiODER3 → 3NazweiSW4 + N / AzweiS.5
Es zerfällt auch, wenn es mit verdünnten Säuren behandelt wird, um Schwefel und Schwefeldioxid zu ergeben (sogenannte Uhrenreaktion):
N / AzweiS.zweiODER3 + 2HCl → 2NaCl + S + SOzwei + H.zweiODER
Reagiert stöchiometrisch (in äquimolaren Mengen) mit wässrigen Jodlösungen und ist daher in Laboratorien für Titrationen auf Jodbasis weit verbreitet.
Reaktivität und Gefahren

Natriumthiosulfat ist kein toxisches Material und wird für medizinische Zwecke verwendet. Bei der Zersetzung entstehen jedoch giftige Schwefeloxiddämpfe, die Augen, Haut und Schleimhäute reizen können..
Die Verbindung kann die Augen, die Haut und die Atemwege reizen. Die Substanz ist giftig für Lunge und Schleimhaut. Wiederholter oder längerer Kontakt mit dem Stoff kann diese Organe schädigen..
Wenn die Verbindung mit den Augen in Kontakt kommt, sollten die Kontaktlinsen überprüft und entfernt werden. Die Augen sollten sofort mindestens 15 Minuten lang mit kaltem Wasser mit viel Wasser gespült werden.
Bei Hautkontakt sollte der betroffene Bereich sofort mindestens 15 Minuten lang mit viel Wasser gespült werden, während kontaminierte Kleidung und Schuhe entfernt werden. Bedecken Sie gereizte Haut mit einem Weichmacher. Waschen Sie Kleidung und Schuhe vor der Wiederverwendung. Bei starkem Kontakt mit einer Desinfektionsseife waschen und die kontaminierte Haut mit einer antibakteriellen Creme abdecken.
Bei Inhalation sollte das Opfer an einen kühlen Ort gebracht werden. Wenn nicht geatmet wird, wird künstlich beatmet. Wenn das Atmen schwierig ist, geben Sie Sauerstoff.
Wenn die Verbindung eingenommen wird, sollte kein Erbrechen ausgelöst werden, es sei denn, dies wird vom medizinischen Personal angeordnet. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
In allen Fällen sollte sofort ein Arzt aufgesucht werden. (Sicherheitsdatenblatt Natriumthiosulfat wasserfrei, 2013).
Anwendungen
Medizin
Natriumthiosulfat kann verwendet werden, um einige der Nebenwirkungen von Cisplatin (einem Krebsmedikament) zu verringern. Es wird zur Behandlung von Extravasationen während der Chemotherapie eingesetzt. Natriumthiosulfat verhindert die Alkylierung und Gewebezerstörung, indem es ein Substrat für Alkylierungsmittel bereitstellt, die in subkutane Gewebe eingedrungen sind.
Es wird auch zusammen mit einem anderen Medikament bei der Notfallbehandlung von Cyanidvergiftungen verwendet (US National Library of Medicine, S.F.)..
Bei dieser Behandlung wird Natriumnitrit intravenös injiziert, um Hämoglobin zu produzieren, das sich mit dem Cyanidion verbindet und es vorübergehend in die Cyanmethoglobinform umwandelt. Anschließend wird das Natriumthiosulfat injiziert.
Thiosulfat dient als Substrat für das Enzym Rhodanase, das die Umwandlung von Cyanid in das viel weniger toxische Thiocyanat katalysiert, das im Urin ausgeschieden wird (HSDB: SODIUM THIOSULFATE, 2003)..
Natriumthiosulfat wird auch zur Behandlung der Calciphylaxie bei Hämodialysepatienten mit Nierenerkrankungen im Endstadium eingesetzt. Es gibt anscheinend ein nicht vollständig verstandenes Phänomen, bei dem dies bei einigen Patienten zu einer schweren metabolischen Azidose führt..
Iodometrie
Natriumthiosulfat reagiert stöchiometrisch mit Jod unter Bildung von Jodid gemäß der Reaktion:
2NazweiS.zweiODER3 + I2 → S.4ODER62− + 2I- -
Diese Eigenschaft bewirkt, dass die Verbindung als Titriermittel bei der Bestimmung von Jod verwendet wird..
Diese besondere Verwendung kann etabliert werden, um den Sauerstoffgehalt von Wasser durch eine lange Reihe von Reaktionen im Winkler-Test auf gelösten Sauerstoff zu messen..
Es wird auch zur volumetrischen Abschätzung der Konzentrationen bestimmter Verbindungen in Lösung (z. B. Wasserstoffperoxid) und zur Abschätzung des Chlorgehalts in handelsüblichem pulverförmigem Bleichmittel und Wasser verwendet..
Wasserentchlorung
Natriumthiosulfat wird zur Entchlorung von Wasser verwendet, einschließlich der Senkung des Chlorgehalts zur Verwendung in Aquarien, Schwimmbädern und Spas sowie in Wasseraufbereitungsanlagen zur Behandlung von etabliertem Rückspülwasser vor der Freisetzung in die Flüsse.
Die Reduktionsreaktion ist analog zur Jodreduktionsreaktion, Thiosulfat reduziert Hypochlorit (Wirkstoff im Bleichmittel) und oxidiert dabei zu Sulfat. Die vollständige Reaktion ist:
4NaClO + NazweiS.zweiODER3 + 2NaOH → 4NaCl + 2NazweiSW4 + H.zweiODER
Gold schürfen
Natriumthiosulfat ist eine Komponente, die als alternatives Auslaugungsmittel zu Cyanid für die Goldextraktion verwendet wird. Es bildet jedoch einen stark löslichen Komplex mit den Gold (I) -Ionen [Au (S.zweiODER3)zwei]]3-.
Der Vorteil dieses Ansatzes besteht darin, dass Thiosulfat im Wesentlichen nicht toxisch ist und dass Mineraltypen, die gegen Goldcyanidierung resistent sind, durch Thiosulfat ausgelaugt werden können (M.G. Aylmore, 2001)..
Verweise
- EMBL-EBI. (2016, 1. Juni). Natriumthiosulfat. Von ebi.ac.uk wiederhergestellt: ebi.ac.uk..
- HSDB: Natriumthiosulfat. (2003, 3. Mai). Aus Toxnet wiederhergestellt: toxnet.nlm.nih.gov.
- G. Aylmore, D. M. (2001). Thiosulfatauswaschung von Gold-A-Review. Minerals Engineering Volume 14, Issue 2, 135-174. sciencedirect.com.
- Sicherheitsdatenblatt Natriumthiosulfat wasserfrei. (2013, 21. Mai). Von sciencelab.com wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie… (2017, 18. März). PubChem Compound Database; CID = 24477. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Royal Society of Chemistry. (2015). Natriumthiosulfat. Von chemspider.com wiederhergestellt.
- Natriumthiosulfat-Formel. (S.F.). Von Softschools wiederhergestellt: softschools.com.
- S. Nationalbibliothek für Medizin. (S.F.). Natriumthiosulfat (in eine Vene). Von ncbi.nlm.nih.gov wiederhergestellt.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.