
Binäre Salze Allgemeine Formel, Nomenklatur und Beispiele
Das binäre Salze sind in der Chemie weithin bekannte ionische Spezies, die aufgrund ihrer vollständigen Dissoziation in ihre Ionenbestandteile in einer Lösung als Substanzen identifiziert werden, die Teil starker Elektrolyte sind.
Der Begriff "binär" bezieht sich auf ihre Bildung, da sie nur aus zwei Elementen bestehen: einem Kation metallischen Ursprungs mit einem einfachen Anion nichtmetallischen Ursprungs (außer Sauerstoff), die durch eine Ionenbindung verbunden sind..
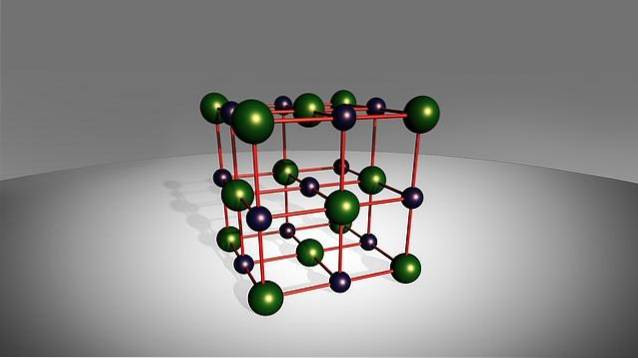
Obwohl ihr Name darauf hinweist, dass sie nur aus zwei Elementen bestehen, verhindert dies nicht, dass in einigen dieser Salze mehr als ein Atom des Metalls, des Nichtmetalls oder beider Spezies vorhanden sein kann. Andererseits zeigen einige dieser Spezies ein ziemlich toxisches Verhalten, wie Natriumfluorid, NaF.
Sie können auch im Kontakt mit Wasser eine hohe Reaktivität zeigen, obwohl diese Eigenschaften zwischen chemisch sehr ähnlichen Salzen enorm variieren können..
Artikelverzeichnis
- 1 Allgemeine Formel der binären Salze
- 2 Nomenklatur der binären Salze
- 2.1 Systematische Nomenklatur
- 2.2 Bestandsnomenklatur
- 2.3 Traditionelle Nomenklatur
- 3 Wie entstehen binäre Salze??
- 4 Beispiele für binäre Salze
- 5 Referenzen
Allgemeine Formel der binären Salze
Wie bereits erwähnt, bestehen binäre Salze in ihrer Struktur aus einem Metall und einem Nichtmetall, daher lautet ihre allgemeine Formel M.mX.n (wobei M das metallische Element und X das nichtmetallische Element ist).
Auf diese Weise können die Metalle, die Teil der binären Salze sind, aus dem "s" -Block des Periodensystems - Alkali (wie Natrium) und Erdalkalimetall (wie Calcium) - oder aus dem "p" -Block des Periodensystems stammen Periodensystem (wie Aluminium).
In gleicher Weise gehören zu den nichtmetallischen Elementen, aus denen diese Art chemischer Substanzen besteht, diejenigen der Gruppe 17 des Periodensystems, die als Halogene (wie Chlor) bekannt sind, sowie andere Elemente des "p" -Blocks, wie z Schwefel oder Stickstoff, außer Sauerstoff.
Nomenklatur der binären Salze
Nach Angaben der Internationalen Union für reine und angewandte Chemie (IUPAC) können drei Systeme zur Benennung von binären Salzen verwendet werden: systematische Nomenklatur, Bestandsnomenklatur und traditionelle Nomenklatur.
Systematische Nomenklatur
Wenn Sie diese Methode verwenden, müssen Sie mit dem Namen des Nichtmetalls beginnen und die Endung -uro hinzufügen. Im Fall eines Bromsalzes (Br) würde es beispielsweise als "Bromid" bezeichnet..
Unmittelbar nach der Benennung des Nichtmetalls wird die Präposition "von" gesetzt; im vorherigen Fall wäre es "Bromid von".
Schließlich wird das metallische Element so benannt, wie es normalerweise genannt wird. Wenn dasselbe Beispiel befolgt wird und es aus Kalium als Metall besteht, würde die Verbindung daher als KBr (dessen Struktur korrekt ausgeglichen ist) geschrieben und als Kaliumbromid bezeichnet..
Falls sich die Stöchiometrie des Salzes von der 1: 1-Kombination unterscheidet, wird jedes Element mit einem Präfix benannt, das den Index oder die Häufigkeit angibt, mit der jedes gefunden wird.
Zum Beispiel das Kombinationsverhältnis im CaCl-Salzzwei es ist 1: 2 (für jedes Kalziumatom gibt es zwei Chlor), daher wird es als Kalziumdichlorid bezeichnet; tritt in gleicher Weise bei den anderen Verbindungen auf.
Aktiennomenklatur
Wenn Sie dieses Verfahren anwenden, benennen Sie die Verbindung zunächst sehr ähnlich wie in der systematischen Nomenklatur, ohne jedoch einen Bestandteil der Substanz vorangestellt zu haben..
In diesem Fall wird nur die Oxidationszahl des metallischen Elements berücksichtigt (sein absoluter Wert in allen Fällen)..
Um das binäre Salz zu benennen, setzen Sie die Valenzzahl in römischer Notation in Klammern nach dem Namen der Art. Als Beispiel kann FeCl angegeben werdenzwei welches nach diesen Regeln Eisen (II) chlorid genannt wird.
Traditionelle Nomenklatur
Wenn die Normen der traditionellen Nomenklatur befolgt werden, wird anstelle eines Präfixes zum Anion oder Kation des Salzes oder zum expliziten Platzieren der Valenzzahl des Metalls ein Suffix in Abhängigkeit von der Oxidationsstufe des Metalls gesetzt.
Um diese Methode zu verwenden, wird das Nichtmetall auf die gleiche Weise wie bei der Stammmethode benannt. Wenn ein Salz vorhanden ist, dessen Elemente mehr als eine Oxidationszahl haben, muss es mit einem Suffix benannt werden, das dies angibt..
Wenn das metallische Element seine niedrigste Oxidationszahl verwendet, wird das Suffix "Bär" hinzugefügt. Wenn Sie dagegen die höchste Valenzzahl verwenden, wird das Suffix "ico" hinzugefügt..
Ein Beispiel hierfür kann die Verbindung FeCl sein3, Dies wird als „Eisenchlorid“ bezeichnet, da Eisen seine maximale Wertigkeit nutzt (3). Im Salz FeClzwei, in dem Eisen seine niedrigste Wertigkeit verwendet (2), wird der Name Eisenchlorid verwendet. Ähnlich verhält es sich mit den anderen.
Wie entstehen binäre Salze??
Wie bereits erwähnt, werden diese Substanzen größtenteils neutraler Natur durch die Kombination mittels einer Ionenbindung eines metallischen Elements (wie die der Gruppe 1 des Periodensystems) und einer nichtmetallischen Spezies (wie die der Gruppe 17 des Periodensystems) gebildet das Periodensystem), außer für Sauerstoff- oder Wasserstoffatome.
Ebenso ist es üblich festzustellen, dass bei chemischen Reaktionen, an denen binäre Salze beteiligt sind, Wärme freigesetzt wird, was bedeutet, dass es sich um eine exotherme Reaktion handelt. Darüber hinaus bestehen je nach dem Salz, mit dem es behandelt wird, verschiedene Risiken.
Beispiele für binäre Salze
Nachfolgend sind einige binäre Salze mit ihren unterschiedlichen Namen aufgeführt, abhängig von der verwendeten Nomenklatur:
NaCl
- Natriumchlorid (traditionelle Nomenklatur)
- Natriumchlorid (Lagernomenklatur)
- Natriummonochlorid (systematische Nomenklatur)
BaClzwei
- Bariumchlorid (traditionelle Nomenklatur)
- Bariumchlorid (Lagernomenklatur)
- Bariumdichlorid (systematische Nomenklatur)
CoS
- Kobaltsulfid (Radionalnomenklatur)
- Kobalt (II) sulfid (Stammnomenklatur)
- Kobaltmonosulfid (systematische Nomenklatur)
Co.zweiS.3
- Kobaltsulfid (traditionelle Nomenklatur)
- Kobalt (III) sulfid (Stammnomenklatur)
- Dicobalttrisulfid (systematische Nomenklatur)
Verweise
- Wikipedia. (s.f.). Binäre Phase. Von en.wikipedia.org wiederhergestellt
- Chang, R. (2007). Chemie, 9. Auflage (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, 2. Auflage. Von books.google.co.ve wiederhergestellt
- Burke, R. (2013). Gefahrstoffchemie für Einsatzkräfte, 3. Auflage. Von books.google.co.ve wiederhergestellt
- Franzosini, P. und Sanesi, M. (2013). Thermodynamische und Transporteigenschaften von organischen Salzen. Von books.google.co.ve wiederhergestellt

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.