
Aluminiumbromid Formel, Eigenschaften und Verwendungen
Das Aluminiumbromid Es ist eine Verbindung, die aus einem Aluminiumatom und einer unterschiedlichen Anzahl von Bromatomen besteht. Es wird in Abhängigkeit von der Anzahl der Valenzelektronen gebildet, die Aluminium hat.
Als Verbindung, die durch ein Metall (Aluminium) und ein Nichtmetall (Brom) verbunden ist, werden kovalente Bindungen gebildet, die den Strukturen eine sehr gute Stabilität verleihen, ohne jedoch die einer Ionenbindung zu erreichen..
Aluminiumbromid ist eine Substanz, die normalerweise in festem Zustand mit kristalliner Struktur vorkommt.
Die Farben der verschiedenen Aluminiumbromide erscheinen als blasse Gelbtöne in verschiedenen Farbtönen und manchmal ohne erkennbare Farbe.
Die Farbe hängt von der Lichtreflexionskapazität der Verbindung ab und ändert sich in Abhängigkeit von den erzeugten Strukturen und den Formen, die sie annimmt..
Der feste Zustand dieser Verbindungen kristallisiert, so dass sie gut definierte Strukturen mit einem ähnlichen Aussehen wie Meersalz aufweisen, jedoch in ihrer Farbe variieren..
Formel
Aluminiumbromid besteht aus einem Aluminiumatom (Al) und unterschiedlichen Mengen an Bromatomen (Br), abhängig von den Valenzelektronen, die Aluminium hat..
Aus diesem Grund kann die allgemeine Formel für Aluminiumbromid wie folgt geschrieben werden: AlBrx, wobei "x" die Anzahl der Bromatome ist, die an Aluminium binden.
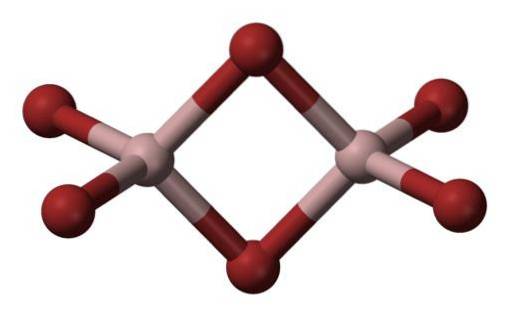
Die häufigste Form, in der es auftritt, ist Al2Br6, ein Molekül mit zwei Aluminiumatomen als Hauptbasen der Struktur..
Die Bindungen zwischen ihnen werden durch zwei Bromatome in der Mitte gebildet, so dass jedes Aluminiumatom vier Bromatome in seiner Struktur hat, aber sie teilen sich wiederum zwei.
Eigenschaften
Aufgrund seiner Natur ist es in Wasser gut löslich, aber im Gegensatz zu anderen Arten von Substanzen ist es auch in Verbindungen wie Methanol und Aceton teilweise löslich..
Es hat ein Molekulargewicht von 267 g / mol und wird durch kovalente Bindungen gebildet.
Natriumbromid erreicht seinen Siedepunkt bei 255 ° C und seinen Schmelzpunkt bei 97,5 ° C..
Ein weiteres Merkmal dieser Verbindung ist, dass sie beim Verdampfen Toxine abgibt. Es wird daher nicht empfohlen, bei hohen Temperaturen ohne ausreichenden Schutz und entsprechende Sicherheitskenntnisse damit zu arbeiten..
Anwendungen
Eine der Verwendungen, die dieser Art von Substanz aufgrund ihrer metallischen und nichtmetallischen Natur gegeben werden, ist die von Mitteln in chemischen Reinheitstests..
Reinheitstests sind sehr wichtig, um die Qualität von Reagenzien zu bestimmen und Produkte herzustellen, mit denen die Menschen zufrieden sind..
In der wissenschaftlichen Forschung wird es sehr unterschiedlich eingesetzt. Zum Beispiel zur Bildung komplexer Strukturen, unter anderem Mittel zur Synthese anderer wertvoller chemischer Produkte, zur Hydrierung von Dihydroxynaphthalinen und zur Selektivität bei Reaktionen..
Diese Verbindung ist im Handel nicht beliebt. Wie oben gezeigt, hat es einige Anwendungen, die sehr spezifisch, aber für die wissenschaftliche Gemeinschaft sehr interessant sind..
Verweise
- Chang, R. (2010). Chemie (10. Aufl.) McGraw-Hill Interamericana.
- Krahl, T. & Kemnitz, E. (2004). Amorphes Aluminiumbromidfluorid (ABF). Angewandte Chemie - Internationale Ausgabe, 43(48), 6653 & ndash; 6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M. & Zakharova, O. (2007). Komplexe von Nitronaphtholen mit Aluminiumbromid. Russisches Journal für Angewandte Chemie, 80(6), 1015 & ndash; 1017. doi: 10.1134 / S107042720706033X
- Koltunov, K. Y. (2008). Kondensation von Naphthalindiolen mit Benzol in Gegenwart von Aluminiumbromid: Eine effiziente Synthese von 5-, 6- und 7-Hydroxy-4-phenyl-1- und 2-tetralonen. Tetraeder-Buchstaben, 49(24), 3891 & ndash; 3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P. & Knochel, P. (2010). Herstellung von Organoaluminiumreagenzien aus durch PbCl2 aktivierten Propargylbromiden und Aluminium und deren regio- und diastereoselektive Addition an Carbonylderivate. Chemie - eine europäische Zeitschrift, 16(32), 9829 & ndash; 9834. doi: 10.1002 / chem.201000523
- Ostashevskaya, L. A., Koltunov, K. Y. & Repinskaya, I. B. (2000). Ionische Hydrierung von Dihydroxynaphthalinen mit Cyclohexan in Gegenwart von Aluminiumbromid. Russisches Journal für Organische Chemie, 36(10), 1474 & ndash; 1477.
- Iijima, T. & Yamaguchi, T. (2008). Effiziente regioselektive Carboxylierung von Phenol zu Salicylsäure mit überkritischem CO2 in Gegenwart von Aluminiumbromid. Journal of Molecular Catalysis A: Chemisch, 295(1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, V. B., Byrikhin, V. S., Nesmelov, A. I., Ezhova, E. A., & Orlinkov, A. V. (1998). 1H-NMR-spektroskopische Untersuchung des kationischen Initiationssystems von tert-Butylchlorid-Aluminiumbromid. Russisches chemisches Bulletin, 47(11), 2149 & ndash; 2154.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.