
Tenecteplase, wofür es ist, Struktur, Wirkmechanismus, Dosis
Das Tenecteplase ist ein Gewebeplasminogenaktivator (tPA), der von der pharmazeutischen Industrie unter Verwendung rekombinanter DNA-Techniken synthetisiert wird, die auf eine Zelllinie angewendet werden, die aus Ovarialzellen des chinesischen Hamsters erhalten wird.
Der Blutgerinnungsprozess, der mit der Bildung eines Thrombus und dem Zurückziehen des Gerinnsels endet, setzt sich mit einer Phase fort, die als Fibrinolyse bezeichnet wird. Diese Phase ist gekennzeichnet durch die Auflösung des Thrombus durch Fragmentierung des Fibrinpolymers in kleinere und löslichere Peptide und die Rekanalisation des Gefäßes oder der Gefäße, in denen eine Koagulation auftrat..
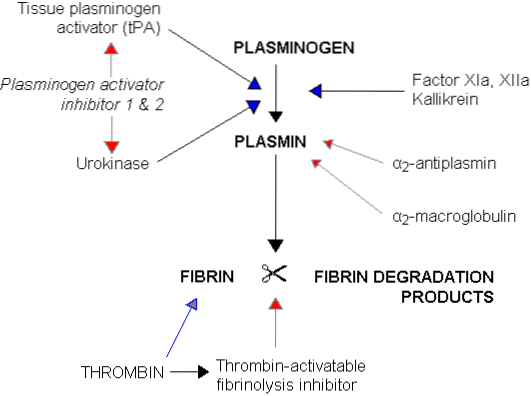
Dieser fibrinolytische Prozess erfordert die Beteiligung eines Blutproteins aus der Gruppe der Plasmaglobuline, genannt Plasminogen oder Profibrinolysin, von etwa 81 kDa, das in der Leber synthetisiert wird und normalerweise im zirkulierenden Blut vorhanden ist. Dieses Plasminogen wird während der Koagulation zwischen den Fibrinnetzwerken, aus denen der Thrombus besteht, eingefangen..
Plasminogen an sich Es fehlt jede fibrinolytische Wirkung, eine Wirkung, die nur auftritt, wenn das ursprüngliche Molekül aktiviert und in Plasmin oder Fibrinolysin umgewandelt wird, eine Serinprotease, die Trypsin, dem wichtigsten proteolytischen Verdauungsenzym bei der Pankreassekretion, sehr ähnlich ist.
Plasmin hat eine hohe Affinität zu Fibrin, das in kleine lösliche Peptide zerfällt, die wiederum die Wirkung von Thrombin und die anschließende Produktion von mehr Fibrin hemmen. Es übt auch eine proteolytische Wirkung auf die Fibrinogen-, Prothrombin- und Gerinnungsfaktoren V, VIII, IX, XI und XII aus, wodurch auch die Gerinnungskapazität des Blutes verringert wird.
Aus dieser Tabelle kann abgeleitet werden, dass Plasmin die Blutgerinnungsprozesse auf zwei Arten beeinflusst, da es einerseits die Auflösung des Thrombus durch seine fibrinolytische Wirkung bewirkt und andererseits die Gerinnung durch seine proteolytische Wirkung auf den Schlüssel stört Faktoren des Gerinnungsprozesses.
Artikelverzeichnis
- 1 Wofür ist Tenecteplase??
- 2 Struktur des Moleküls
- 3 Wirkmechanismus
- 4 Präsentation
- 5 Dosis
- 6 Referenzen
Wofür ist Tenecteplase??
Die Plasminogenaktivierung erfolgt durch die individuelle oder kombinierte Wirkung einer Reihe von Substanzen, die allgemein als Plasminogenaktivatoren bezeichnet werden und die je nach Herkunft in Plasminogenaktivatoren eingeteilt sind: Blut, Urin, Gewebe und Mikroorganismen.
Als Gewebeplasminogenaktivator, der es in Plasmin umwandelt, und als Plasmin als Fibrinolytikum schlechthin, da Tenecteplase zur therapeutischen Fibrinolyse bei akutem Myokardinfarkt, thromboembolischen Schlaganfällen und Lungenthromboembolien eingesetzt wird..
Struktur des Moleküls
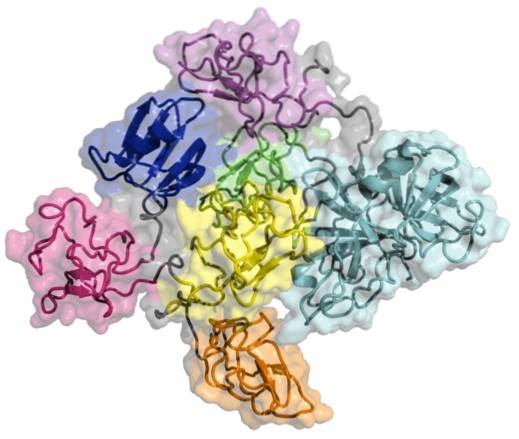
Tenecteplase ist ein Glykoprotein mit 527 Aminosäuren in seiner Primärstruktur, in dem zwei basische Domänen unterschieden werden, eine als Kringeldomäne und die andere als Protease-Domäne.
Die Kringeldomäne ist ein Bereich des Proteins, der sich zu großen Schleifen faltet, die durch Disulfidbindungen stabilisiert werden. Diese Art von Domäne ist sehr wichtig, da sie Protein-Protein-Wechselwirkungen ermöglicht, die mit Blutgerinnungsfaktoren auftreten, und ihren Namen von einem skandinavischen Kuchen erhält, dessen Form ihm ähnelt..
Die Protease-Domäne ist der Bereich des Moleküls, der die proteolytische Aktivität aufweist, die dem Enzym selbst seine aktivierende Funktion verleiht..
Die Struktur des Moleküls ist der von natürlichem menschlichem tPA sehr ähnlich, jedoch ermöglichte die rekombinante DNA-Technologie die Einführung einiger Modifikationen in seiner komplementären DNA (cDNA), die dem darin kodierten Protein einige therapeutische Vorteile verleihen.
Diese Modifikationen umfassen die Substitution von Threonin an Position 103 durch Asparagin und Asparagin 117 durch Glutamin, Änderungen, die sich in der Kringeldomäne befinden; während in der Protease-Domäne eine Tetra-Alanin-Anordnung im Positionsbereich 296-299 erreicht wurde.
Wirkmechanismus
Der Wirkungsmechanismus von Tenecteplase ähnelt dem von natürlichem tPA. Sobald sich der Thrombus gebildet hat, bindet Plasminogen in seiner inaktiven Form an Fibrin, ohne eine proteolytische Wirkung auf ihn auszuüben..
Das von Endothelzellen produzierte tPA bindet an Fibrin und erwirbt dadurch seine plasminogenaktivierende Eigenschaft in Plasmin, einer Substanz, die die Fibrinolyse auslöst.
Die Modifikationen, die im tPA-Molekül erzeugt und in Tenecteplase eingebaut werden, machen die aktivierende Wirkung dieser Substanz auf Plasminogen empfindlicher gegenüber der Anwesenheit von Fibrin. Fibrinspezifität, die ihre Wirkung auf Thrombusstellen beschränkt und die systemische Plasminogenaktivierung und den daraus resultierenden Abbau von Plasmafibrinogen reduziert.
Präsentation
Die Dosierung oder Wirksamkeit der Substanz wird in mg und in Einheiten (U) Tenecteplase ausgedrückt. Die Einheiten stellen einen spezifischen Referenzstandard für das Arzneimittel dar und sind nicht mit den Einheiten anderer Thrombolytika vergleichbar. Ein mg entspricht 200 Einheiten (U).
Eine Geschäftsform ist die Metalyse, Dies erfolgt in zwei Präsentationen, von denen jede eine Durchstechflasche mit dem Produkt in Form eines weißen Pulvers und eine Fertigspritze mit dem transparenten und farblosen Lösungsmittel zur Rekonstitution enthält.
In einem von ihnen enthält das Fläschchen 8000 Einheiten (40 mg) und die Spritze 8 ml Lösungsmittel. In der anderen enthält die Durchstechflasche 10.000 U (50 mg) und die Spritze 10 ml. In beiden Fällen enthält die Lösung nach der Rekonstitution durch Zugabe des Spritzeninhalts in die entsprechende Durchstechflasche 1000 Einheiten (5 mg) pro ml und erscheint klar und farblos oder leicht gelb..
Dosis
Die Behandlung mit Tenecteplase sollte so schnell wie möglich innerhalb von 6 Stunden nach Auftreten der Symptome begonnen werden. Aufgrund des impliziten Risikos von Blutungen oder Blutungen sollte es von Ärzten mit Erfahrung in der thrombolytischen Behandlung und in Einrichtungen verschrieben werden, die über die Mittel verfügen, um diese Art von Nebenwirkungen zu überwachen und ihnen entgegenzuwirken..

Die Dosierung der Substanz sollte auf dem Körpergewicht basieren, wobei eine Mindestdosis von 6000 Einheiten, entsprechend 30 mg, gelöst in einem Volumen von 6 ml der rekonstituierten Lösung, bei Patienten mit einem Körpergewicht unter 60 kg verabreicht werden sollte..
Die maximale Dosis beträgt 10.000 U (50 mg / 10 ml Lösung) und ist Patienten mit einem Körpergewicht von 90 kg und mehr vorbehalten..
Das Dosierungsschema für Patienten mit einem Gewicht zwischen 60 und unter 90 kg lautet wie folgt:
- ≥ 60 a < 70 = 7000 U (35 mg/7 ml)
- ≥ 70 a < 80 = 8000 U (40 mg/8 ml)
- ≥ 80 a < 90 = 9000 U (45 mg/9 ml)
Die erforderliche Dosis sollte als einzelner intravenöser Bolus und über einen Zeitraum von etwa 10 Sekunden verabreicht werden. Es kann über einen zuvor angeschlossenen intravenösen Kreislauf verabreicht werden, durch den eine physiologische Lösung von 0,9% Natriumchlorid (9 mg / ml) geleitet wird.
Das Arzneimittel ist mit Glucoselösungen nicht kompatibel, und obwohl nach den derzeitigen therapeutischen Kriterien eine adjuvante antithrombotische Behandlung, die Thrombozytenaggregationshemmer und Antikoagulanzien umfassen könnte, parallel verabreicht werden sollte, sollte der injizierbaren Tenecteplase-Lösung kein anderes Arzneimittel zugesetzt werden..
Verweise
- Balsera, E. C., Palomino, M. Á. P., Ordoñez, J. M., Caler, C. L., Paredes, T. G., & García, G. Q. (2011). Wirksamkeit und Sicherheit von Alteplase gegenüber Tenecteplase bei der Fibrinolyse des akuten Koronarsyndroms mit ST-Hebung. Cardiocore, 46(4), 150 & ndash; 154.
- Bauer C und Walzog B: Blut: ein Flüssiges Organsystem, in: Physiologie, 6. Ausgabe; R. Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- D. M. Fatovich, G. J. Dobb & R. A. Clugston (2004). Eine randomisierte Pilotstudie zur Thrombolyse bei Herzstillstand (TICA-Studie). Reanimation, 61(3), 309 & ndash; 313.
- Guyton AC, Halle JE: Blutstillung und Blutgerinnung, in: Lehrbuch der Medizinischen Physiologie , 13. Ausgabe, AC Guyton, JE Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Haley Jr., E. C., Lyden, P. D., Johnston, K. C., Hemmen, T. M. und TNK in Stroke Investigators. (2005). Eine Pilotstudie zur Dosis-Eskalations-Sicherheit von Tenecteplase bei akutem ischämischem Schlaganfall. Schlaganfall, 36(3), 607-612.
- Jelkman W: Blut, in: Physiologie des Menschen mit Pathophysiologie, 31. Auflage, RF Schmidt et al. (Hrsg.). Heidelberg, Springer Medizin Verlag, 2010.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.