
Aluminiumhydroxidstruktur, Eigenschaften, Verwendungen, Risiken
Das Aluminiumhydroxid ist eine anorganische Verbindung mit der chemischen Formel Al (OH)3. Im Gegensatz zu anderen Metallhydroxiden handelt es sich um ein amphoteres Hydroxid, das je nach Medium wie eine Säure oder Base reagieren oder sich verhalten kann. Es ist ein weißer Feststoff, der in Wasser ziemlich unlöslich ist, und findet daher Verwendung als Bestandteil von Antazida.
Wie Mg (OH)zwei oder Brucit, mit dem es bestimmte chemische und physikalische Eigenschaften teilt, in reiner Form sieht es aus wie ein stumpfer, amorpher Feststoff; aber wenn es mit einigen Verunreinigungen kristallisiert, nimmt es kristalline Formen an, als wären sie Perlen. Unter diesen Mineralien sind natürliche Quellen von Al (OH)3, Die Gibbsit wird gefunden.

Neben Gibbsit gibt es auch die Mineralien Bayerit, Nordstrandit und Doleyit, die die vier Polymorphe von Aluminiumhydroxid bilden. Strukturell sind sie einander sehr ähnlich und unterscheiden sich kaum in der Art und Weise, in der die Ionenschichten oder -schichten positioniert oder gekoppelt sind, sowie in der Art der enthaltenen Verunreinigungen.
Durch Steuern des pH-Werts und der Syntheseparameter kann jedes dieser Polymorphe hergestellt werden. Einige interessierende chemische Spezies können auch zwischen ihren Schichten interkaliert werden, so dass Interkalationsmaterialien oder -verbindungen erzeugt werden. Dies stellt die Verwendung eines technologischeren Ansatzes für Al (OH) dar3. Seine anderen Verwendungen sind als Antazida.
Andererseits wird es als Rohmaterial zur Gewinnung von Aluminiumoxid verwendet, und seine Nanopartikel wurden als katalytischer Träger verwendet..
Artikelverzeichnis
- 1 Struktur
- 1.1 Formel und Oktaeder
- 1.2 Polymorphe
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Dichte
- 2.4 Schmelzpunkt
- 2.5 Löslichkeit in Wasser
- 2.6 Löslichkeitsprodukt
- 2.7 Amphoterismus
- 3 Nomenklatur
- 4 Verwendungen
- 4.1 Rohmaterial
- 4.2 Katalytische Träger
- 4.3 Interkalationsverbindungen
- 4.4 Feuerhemmend
- 4.5 Medizin
- 4.6 Adsorbens
- 5 Risiken
- 6 Referenzen
Struktur
Formel und Oktaeder
Die chemische Formel Al (OH)3 zeigt sofort an, dass die Beziehung Al3+: OH- ist 1: 3; Das heißt, es gibt drei OH-Anionen- für jedes Al-Kation3+, Das ist das gleiche wie zu sagen, dass ein Drittel seiner Ionen Aluminium entspricht. So ist die Al3+ und OH- elektrostatisch interagieren, bis ihre Anziehungsabstoßungen einen hexagonalen Kristall definieren.
Die Al3+ nicht unbedingt von drei OH umgeben- aber sechs; daher sprechen wir von einem Koordinationsoktaeder, Al (OH)6, in denen es sechs Al-O-Wechselwirkungen gibt. Jedes Oktaeder stellt eine Einheit dar, mit der der Kristall aufgebaut ist, und einige von ihnen nehmen trikline oder monokline Strukturen an.
Das untere Bild zeigt teilweise die Al (OH) -Oktaeder6, da für das Al nur vier Wechselwirkungen beobachtet werden3+ (hellbraune Kugeln).
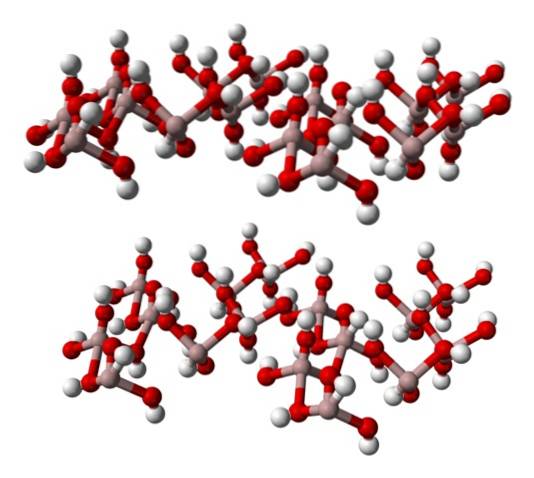
Wenn diese Struktur sorgfältig beobachtet wird, die der des Minerals Gibbsit entspricht, ist ersichtlich, dass die weißen Kugeln die "Flächen" oder Oberflächen der Ionenschichten bilden; Dies sind die Wasserstoffatome der OH-Ionen-.
Beachten Sie auch, dass es eine Schicht A und eine andere B gibt (räumlich sind sie nicht identisch), die durch Wasserstoffbrücken miteinander verbunden sind..
Polymorphe
Die Schichten A und B sind nicht immer auf die gleiche Weise gekoppelt, ebenso wie sich ihre physikalische Umgebung oder Wirtsionen (Salze) ändern können. Folglich Al (OH) -Kristalle3 variieren in vier mineralogischen oder in diesem Fall polymorphen Formen.
Aluminiumhydroxid soll dann bis zu vier Polymorphe aufweisen: Gibbsit oder Hydrargillit (monoklin), Bayerit (monoklin), Doylit (triklin) und Nordstrandit (triklin). Von diesen Polymorphen ist Gibbsit das stabilste und am häufigsten vorkommende; Die anderen werden als seltene Mineralien eingestuft.
Wenn die Kristalle unter einem Mikroskop beobachtet würden, würde man sehen, dass ihre Geometrie hexagonal ist (obwohl etwas unregelmäßig). Der pH-Wert spielt eine wichtige Rolle beim Wachstum solcher Kristalle und bei der resultierenden Struktur; das heißt, bei gegebenem pH kann ein Polymorph oder ein anderes gebildet werden.
Zum Beispiel, wenn das Medium, in dem Al (OH) ausfällt3 es hat einen pH-Wert von weniger als 5,8. Wenn der pH-Wert höher als dieser Wert ist, wird Bayerit gebildet.
In grundlegenderen Medien neigen Nordstrandit- und Doyrititkristalle zur Bildung. Da es sich um die am häufigsten vorkommende Gibbsit handelt, ist dies eine Tatsache, die den Säuregehalt seiner verwitterten Umgebung widerspiegelt..
Eigenschaften
Aussehen
Weißer Feststoff, der in verschiedenen Formaten vorliegen kann: körnig oder pulverförmig und amorph.
Molmasse
78,00 g / mol
Dichte
2,42 g / ml
Schmelzpunkt
300 ° C. Es hat keinen Siedepunkt, da das Hydroxid Wasser verliert, um sich in Aluminiumoxid oder Aluminiumoxid Al umzuwandelnzweiODER3.
Wasserlöslichkeit
1 10-4 g / 100 ml. Seine Löslichkeit nimmt jedoch mit der Zugabe von Säuren (H) zu3ODER+) oder Alkalien (OH-).
Löslichkeitsprodukt
K.sp = 3 10−34
Dieser sehr kleine Wert bedeutet, dass sich nur ein winziger Teil im Wasser löst:
Al (OH)3(s) <=> Zum3+(aq) + 3OH-(ac)
Tatsächlich macht diese vernachlässigbare Löslichkeit es zu einem guten Säureneutralisator, da es die Magenumgebung nicht zu stark basisch macht, da es fast keine OH-Ionen freisetzt.-.
Amphoterismus
El Al (OH)3 es zeichnet sich durch seinen amphoteren Charakter aus; Das heißt, es kann reagieren oder sich so verhalten, als wäre es eine Säure oder eine Base.
Zum Beispiel reagiert es mit H-Ionen3ODER+ (wenn das Medium wässrig ist) unter Bildung des komplexen wässrigen [Al (OHzwei)6]]3+;; welches wiederum hydrolysiert wird, um das Medium anzusäuern, daher Al3+ ein Säureion:
Al (OH)3(s) + 3H3ODER+(ac) => [Al (OHzwei)6]]3+(ac)
[Al (OHzwei)6]]3+(ac) + H.zweiO (l) <=> [Al (OHzwei)5(OH)]zwei+(ac) + H.3ODER+(ac)
Wenn dies geschieht, wird gesagt, dass das Al (OH)3 verhält sich wie eine Base, da sie mit dem H reagiert3ODER+. Andererseits kann es mit dem OH reagieren-, benimmt sich wie eine Säure:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
Bei dieser Reaktion fällt der weiße Niederschlag von Al (OH)3 löst sich im Überschuss an OH-Ionen-;; Tatsache, dass dies bei anderen Hydroxiden wie Magnesium, Mg (OH) nicht der Fall ist.zwei.
El Al (OH)4-, Alumination kann geeigneter ausgedrückt werden als: [Al (OHzwei)zwei(OH)4]]-, Hervorheben der Koordinationsnummer 6 für das Al-Kation3+ (das Oktaeder).
Dieses Ion kann weiterhin mit mehr OH reagieren- bis zur Vervollständigung des Koordinationsoktaeders: [Al (OH)6]]3-, genannt Hexahydroxoaluminat-Ion.
Nomenklatur
Der Name "Aluminiumhydroxid", mit dem mehr auf diese Verbindung Bezug genommen wurde, entspricht dem Namen, der in der Bestandsnomenklatur geregelt ist. Das (III) wird am Ende weggelassen, da die Oxidationsstufe von Aluminium in allen seinen Verbindungen +3 beträgt.
Die beiden anderen möglichen Namen beziehen sich auf Al (OH)3 Dies sind: Aluminiumtrihydroxid gemäß der systematischen Nomenklatur und der Verwendung der griechischen Zählerpräfixe; und Aluminiumhydroxid, das mit dem Suffix -ico endet, um eine einzige Oxidationsstufe zu haben.
Obwohl im chemischen Bereich die Nomenklatur von Al (OH)3 stellt keine Herausforderung oder Verwirrung dar, außerhalb davon neigt es dazu, mit Zweideutigkeiten vermischt zu werden.
Beispielsweise ist das Mineral Gibbsit eines der natürlichen Polymorphe von Al (OH)3, die sie auch als γ-Al (OH) bezeichnen3 oder α-Al (OH)3. Α-Al (OH)3 kann auch dem Mineral Bayerit oder β-Al (OH) entsprechen3, nach kristallographischer Nomenklatur. Inzwischen werden die Polymorphe Nordstrandit und Doylite üblicherweise einfach als Al (OH) bezeichnet.3.
Die folgende Liste fasst klar zusammen, was gerade erklärt wurde:
-Gibbsit: (γ oder α) -Al (OH)3
-Bayerit: (α oder β) -Al (OH)3
-Nordstrandit: Al (OH)3
-Doyleit: Al (OH)3
Anwendungen
Rohstoff
Aluminiumhydroxid wird sofort als Rohstoff für die Herstellung von Aluminiumoxid oder anderen anorganischen oder organischen Aluminiumverbindungen verwendet. zum Beispiel: AlCl3, Durch nicht3)3, AlF3 oder NaAl (OH)4.
Katalytische Träger
Nanopartikel aus Al (OH)3 sie können als katalytische Träger wirken; Das heißt, der Katalysator verbindet sich mit ihnen, um auf ihrer Oberfläche fixiert zu bleiben, wo chemische Reaktionen beschleunigt werden.
Interkalationsverbindungen
Im Abschnitt über Strukturen wurde erklärt, dass Al (OH)3 Es besteht aus Schichten oder Schichten A und B, die gekoppelt sind, um einen Kristall zu definieren. Im Inneren befinden sich kleine oktaedrische Räume oder Löcher, die von anderen Ionen, metallischen oder organischen oder neutralen Molekülen besetzt werden können..
Wenn Al (OH) -Kristalle synthetisiert werden3 Mit diesen strukturellen Modifikationen soll eine Interkalationsverbindung hergestellt werden; das heißt, sie fügen chemische Spezies zwischen den Blättern A und B ein oder fügen sie ein. Dabei entstehen neue Materialien, die aus diesem Hydroxid hergestellt werden.
Feuerdämmend
El Al (OH)3 Es ist ein gutes Flammschutzmittel, das als Füllstoff für viele Polymermatrizen Anwendung findet. Dies liegt daran, dass es Wärme absorbiert, um Wasserdampf freizusetzen, genau wie Mg (OH).zwei oder die Brucita.
Medizinisch
El Al (OH)3 Es ist auch ein Neutralisator der Säure, der mit der HCl in Magensekreten reagiert; wieder ähnlich wie Mg (OH)zwei Magnesia-Milch.
Beide Hydroxide können tatsächlich in verschiedenen Antazida gemischt werden, um die Symptome von Menschen mit Gastritis oder Magengeschwüren zu lindern..
Adsorbens
Beim Erhitzen unter seinen Schmelzpunkt wandelt sich Aluminiumhydroxid in aktiviertes Aluminiumoxid (sowie Aktivkohle) um. Dieser Feststoff wird als Adsorbens für unerwünschte Moleküle verwendet, ob Farbstoffe, Verunreinigungen oder Schadgase..
Risiken
Die Risiken, die Aluminiumhydroxid darstellen kann, sind nicht auf einen Feststoff, sondern auf ein Arzneimittel zurückzuführen. Es benötigt kein Protokoll oder Vorschriften, um es zu lagern, da es nicht heftig mit Oxidationsmitteln reagiert und nicht brennbar ist..
Bei Einnahme in Antazida, die in Apotheken erhältlich sind, können unerwünschte Nebenwirkungen auftreten, wie Verstopfung und Hemmung von Phosphat im Darm. Ebenso und obwohl es keine Studien gibt, die dies belegen, wurde es mit neurologischen Störungen wie der Alzheimer-Krankheit in Verbindung gebracht.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Aluminiumhydroxid. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Aluminiumhydroxid. PubChem-Datenbank. CID = 10176082. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Aluminiumhydroxid: Formel & Nebenwirkungen. Studie. Wiederhergestellt von: study.com
- Robert Schoen & Charles E. Roberson. (1970). Strukturen von Aluminiumhydroxid und geochemische Implikationen. The American Mineralogist, Vol 55.
- Vitaly P. Isupov & col. (2000). Synthese, Struktur, Eigenschaften und Anwendung von Aluminiumhydroxid-Interkalationsverbindungen. Chemie für nachhaltige Entwicklung 8,121-127.
- Drogen. (24. März 2019). Nebenwirkungen von Aluminiumhydroxid. Wiederhergestellt von: drugs.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.