
Struktur, Eigenschaften und Verwendung von Zinksulfid (ZnS)
Das Zinksulfid ist eine anorganische Verbindung der Formel Z.nS, gebildet durch Zn-Kationenzwei+ und S Anionenzwei-. Es kommt in der Natur hauptsächlich als zwei Mineralien vor: Wurtzit und Sphalerit (oder Zinkblende), wobei letzteres seine Hauptform ist.
Sphalerit ist aufgrund der darin enthaltenen Verunreinigungen von Natur aus schwarz. In seiner reinen Form hat es weiße Kristalle, während Wurtzit grauweiße Kristalle hat..

Zinksulfid ist wasserunlöslich. Es kann Umweltschäden verursachen, da es in den Boden eindringt und das Grundwasser und seine Strömungen verunreinigt.
Zinksulfid kann unter anderem durch Korrosion und Neutralisation hergestellt werden.
Durch Korrosion:
Zn + H.zweiS => ZnS + H.zwei
Durch Neutralisation:
H.zweiS + Zn (OH)zwei => ZnS + 2HzweiODER
Zinksulfid ist ein phosphoreszierendes Salz, das für mehrere Anwendungen und Anwendungen geeignet ist. Darüber hinaus ist es ein Halbleiter und ein Photokatalysator.
Artikelverzeichnis
- 1 Struktur
- 1.1 Zinkmischung
- 1.2 Wurzita
- 2 Eigenschaften
- 2.1 Farbe
- 2.2 Schmelzpunkt
- 2.3 Löslichkeit in Wasser
- 2.4 Löslichkeit
- 2.5 Dichte
- 2.6 Härte
- 2.7 Stabilität
- 2.8 Zersetzung
- 3 Nomenklatur
- 3.1 Systematische und traditionelle Nomenklaturen
- 4 Verwendungen
- 4.1 Als Pigmente oder Beschichtungen
- 4.2 Wegen seiner Phosphoreszenz
- 4.3 Halbleiter, Photokatalysator und Katalysator
- 5 Referenzen
Struktur
Zinksulfid nimmt kristalline Strukturen an, die durch elektrostatische Anziehungskräfte zwischen dem Zn-Kation gesteuert werdenzwei+ und das Anion S.zwei-. Dies sind zwei: Sphalerit oder Zinkmischung und Wurzit. In beiden Fällen minimieren die Ionen die Abstoßungen zwischen Ionen gleicher Ladung..
Die Zinkmischung ist unter den terrestrischen Bedingungen von Druck und Temperatur am stabilsten; und Wurzit, das weniger dicht ist, resultiert aus einer kristallinen Umlagerung aufgrund einer erhöhten Temperatur.
Die beiden Strukturen können gleichzeitig im selben ZnS-Feststoff koexistieren, obwohl der Wurtit sehr langsam dominiert..
Zinkmischung

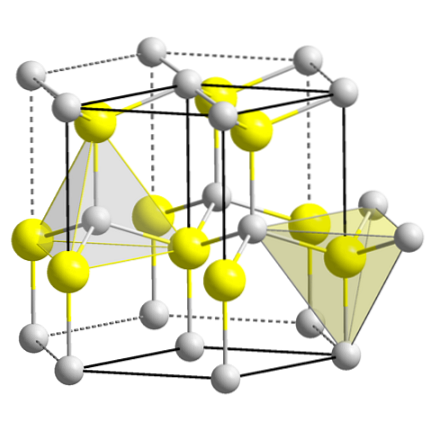
Das obere Bild zeigt die kubische Einheitszelle, die auf den Flächen der Zinkblendestruktur zentriert ist. Die gelben Kugeln entsprechen den Anionen S.zwei-, und die grauen zu den Zn-Kationenzwei+, befindet sich an den Ecken und in der Mitte der Würfelflächen.
Beachten Sie die tetraedrischen Geometrien um die Ionen. Die Zinkmischung kann auch durch diese Tetraeder dargestellt werden, deren Löcher im Kristall dieselbe Geometrie haben (tetraedrische Löcher)..
Ebenso ist innerhalb der Einheitszellen der ZnS-Anteil erfüllt; das heißt, ein Verhältnis von 1: 1. Somit für jedes Zn-Kationzwei+ es gibt ein Anion S.zwei-. Auf dem Bild scheint es, dass es viele graue Kugeln gibt, aber in Wirklichkeit werden sie von anderen Zellen geteilt, da sie sich in den Ecken und in der Mitte der Würfelflächen befinden.
Wenn Sie zum Beispiel die vier gelben Kugeln nehmen, die sich in der Box befinden, sollten die „Teile“ aller grauen Kugeln um sie herum gleich vier sein (und das tun sie auch). Somit gibt es in der kubischen Einheitszelle vier Znzwei+ und vier S.zwei-, Erfüllung des stöchiometrischen Verhältnisses ZnS.
Es ist auch wichtig zu betonen, dass sich vor und hinter den gelben Kugeln (dem Raum, der sie voneinander trennt) tetraedrische Löcher befinden..
Wurzita
Im Gegensatz zur Struktur der Zinkmischung nimmt Wurzit ein hexagonales Kristallsystem an (oberes Bild). Dies ist weniger kompakt, so dass der Feststoff eine geringere Dichte hat. Die Ionen in Wurzit haben auch eine tetraedrische Umgebung und ein Verhältnis von 1: 1, das mit der ZnS-Formel übereinstimmt..
Eigenschaften
Farbe
Es kann auf drei Arten präsentiert werden:
-Wurtzit mit weißen und sechseckigen Kristallen.
-Sphalerit mit grauweißen Kristallen und kubischen Kristallen.
-Als weißes bis grauweißes oder gelbliches Pulver und kubische gelbliche Kristalle.
Schmelzpunkt
1700º C..
Wasserlöslichkeit
Praktisch unlöslich (0,00069 g / 100 ml bei 18 ° C).
Löslichkeit
In Alkalien unlöslich, in verdünnten Mineralsäuren löslich.
Dichte
Sphalerit 4,04 g / cm3 und Wurtzit 4,09 g / cm3.
Härte
Hat eine Härte von 3 bis 4 auf der Mohs-Skala.
Stabilität
Wenn es Wasser enthält, oxidiert es langsam zu Sulfat. In trockener Umgebung ist es stabil.
Zersetzung
Beim Erhitzen auf hohe Temperaturen entstehen giftige Dämpfe von Zink- und Schwefeloxiden.
Nomenklatur
Die Elektronenkonfiguration von Zn ist [Ar] 3d104szwei. Durch den Verlust der beiden Elektronen des 4s-Orbitals bleibt es als Zn-Kation erhaltenzwei+ mit ihren d Orbitalen gefüllt. Daher ist da elektronisch Znzwei+ es ist viel stabiler als Zn+, es hat nur eine Wertigkeit von +2.
Daher wird es für die Bestandsnomenklatur weggelassen, indem seine in Klammern und mit römischen Ziffern eingeschlossene Wertigkeit hinzugefügt wird: Zinksulfid (II).
Systematische und traditionelle Nomenklaturen
Es gibt aber auch andere Möglichkeiten, das ZnS aufzurufen, zusätzlich zu der bereits angesprochenen. In der Systematik wird die Anzahl der Atome jedes Elements mit den griechischen Zählern angegeben; mit der einzigen Ausnahme des Elements rechts, wenn es nur eines ist. Somit wird das ZnS wie folgt benannt: AffeZinksulfid (und nicht Monozinkmonosulfid).
In Bezug auf die traditionelle Nomenklatur wird Zink mit einer einzigen Wertigkeit von +2 durch Hinzufügen des Suffix -ico hinzugefügt. Folglich ergibt sich sein traditioneller Name: Zinksulfidico.
Anwendungen
Als Pigmente oder Beschichtungen
-Sachtolith ist ein weißes Pigment aus Zinksulfid. Wird in Dichtungsmassen, Kitten, Dichtungsmassen, Grundierungen, Latexfarben und Beschilderungen verwendet.
Die Verwendung in Kombination mit UV-absorbierenden Pigmenten wie Mikrotitan oder transparenten Eisenoxidpigmenten ist bei wetterbeständigen Pigmenten erforderlich.
-Wenn ZnS auf Latex- oder Strukturfarben aufgetragen wird, hat es eine verlängerte mikrobizide Wirkung.
-Aufgrund seiner hohen Härte und Beständigkeit gegen Bruch, Erosion, Regen oder Staub eignet es sich für Außeninfrarotfenster oder in Flugzeugrahmen.
-ZnS wird bei der Beschichtung von Rotoren verwendet, die beim Transport von Verbindungen verwendet werden, um den Verschleiß zu verringern. Es wird auch zur Herstellung von Druckfarben, Isoliermassen, thermoplastischer Pigmentierung, schwer entflammbaren Kunststoffen und Elektrolumineszenzlampen verwendet..
-Zinksulfid kann transparent sein und als Fenster für sichtbare Optiken und Infrarotoptiken verwendet werden. Wird in Nachtsichtgeräten, Fernsehbildschirmen, Radarschirmen und fluoreszierenden Beschichtungen verwendet.
-ZnS mit Cu-Dotierung wird zur Herstellung von Elektrolumineszenzplatten verwendet. Es wird auch beim Raketenantrieb und bei der Gravimetrie eingesetzt.
Für seine Phosphoreszenz
-Seine Phosphoreszenz wird verwendet, um die Uhrzeiger zu tönen und so die Zeit im Dunkeln anzuzeigen; auch in Farbe für Spielzeug, in Notschildern und Verkehrswarnungen.
Die Phosphoreszenz ermöglicht die Verwendung von Zinksulfid in Kathodenstrahlröhren und Röntgenschirmen, um in dunklen Flecken zu leuchten. Die Farbe der Phosphoreszenz hängt vom verwendeten Aktivator ab.
Halbleiter, Photokatalysator und Katalysator
-Sphalerit und Wurtzit sind Breitbandspalthalbleiter. Sphalerit hat eine Bandspalte von 3,54 eV, während Wurtzit eine Bandspalte von 3,91 eV hat.
-ZnS wird zur Herstellung eines Photokatalysators aus CdS-ZnS / Zirkonium-Titanphosphat verwendet, der zur Wasserstoffproduktion unter sichtbarem Licht verwendet wird.
-Es wirkt als Katalysator für den Abbau organischer Schadstoffe. Wird zur Herstellung eines Farbsynchronisierers in LED-Lampen verwendet.
-Seine Nanokristalle werden zum Nachweis von ultrasensitiven Proteinen verwendet. Zum Beispiel durch Emission von Licht von Quantenpunkten von ZnS. Es wird zur Herstellung eines kombinierten Photokatalysators (CdS / ZnS) -TiO2 zur elektrischen Erzeugung durch Photoelektrokatalyse verwendet.
Verweise
- PubChem. (2018). Zinksulfid. Entnommen aus: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16. Januar). Weißpigment auf Zinksulfidbasis. Wiederhergestellt von: quiminet.com
- Wikipedia. (2018). Zinksulfid. Entnommen aus: en.wikipedia.org
- II-VI UK. (2015). Zinksulfid (ZnS). Entnommen aus: ii-vi.es
- Rob Toreki. (2015, 30. März). Die Zinkblende (ZnS) -Struktur. Entnommen aus: ilpi.com
- Chemie LibreTexts. (22. Januar 2017). Struktur-Zink-Blende (ZnS). Entnommen aus: chem.libretexts.org
- Reade. (2018). Zinksulfid / Zinksulfid (ZnS). Entnommen aus: reade.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.