
Hunds Regel oder Prinzip der maximalen Multiplizität
Das Hunds Regel oder Prinzip der maximalen Multiplizität legt empirisch fest, wie sich die Energie-entarteten Orbitalelektronen besetzen müssen. Diese Regel stammt, wie der Name schon sagt, 1927 vom deutschen Physiker Friedrich Hund und ist seitdem in der Quanten- und spektroskopischen Chemie sehr nützlich..
Es gibt wirklich drei Hundsche Regeln, die in der Quantenchemie angewendet werden; Die erste ist jedoch die einfachste für das grundlegende Verständnis der elektronischen Strukturierung eines Atoms.
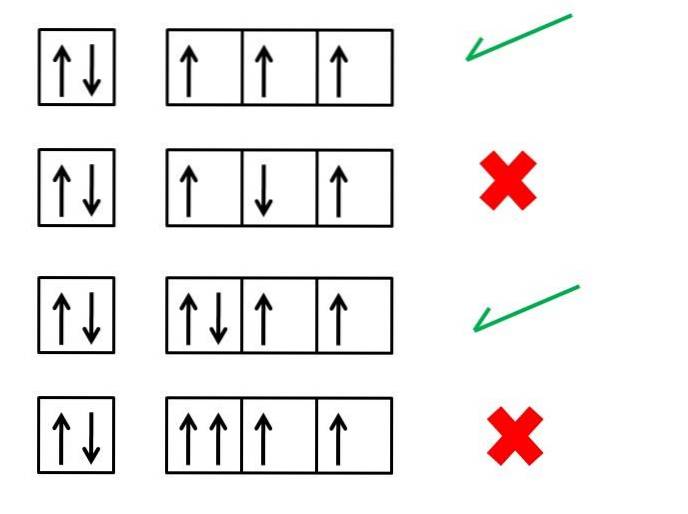
Die erste Regel von Hund, die der maximalen Vielfalt, ist wichtig, um die elektronischen Konfigurationen der Elemente zu verstehen. legt die Reihenfolge der Elektronen in den Orbitalen fest, um ein Atom (Ion oder Molekül) mit größerer Stabilität zu erzeugen.
Das obige Bild zeigt beispielsweise vier Reihen von Elektronenkonfigurationen; Die Kästchen repräsentieren die Orbitale und die schwarzen Pfeile repräsentieren die Elektronen.
Die erste und dritte Reihe entsprechen den korrekten Ordnungsweisen der Elektronen, während die zweite und vierte Reihe angeben, wie die Elektronen nicht in den Orbitalen platziert werden sollen.
Artikelverzeichnis
- 1 Reihenfolge der Füllung der Orbitale nach Hunds Regel
- 1.1 Pairing von Spins
- 1.2 Parallele und antiparallele Drehungen
- 2 Vielfältigkeit
- 3 Übungen
- 3.1 Fluor
- 3.2 Titan
- 3.3 Eisen
- 4 Referenzen
Orbitalfüllreihenfolge nach Hunds Regel
Obwohl die anderen beiden Hund-Regeln nicht erwähnt werden, werden diese drei Regeln bei korrekter Ausführung der Füllreihenfolge implizit gleichzeitig angewendet.
Was haben die erste und dritte Reihe von Orbitalen im Bild gemeinsam? Warum sind sie richtig? Für den Anfang kann jedes Orbital nur zwei Elektronen „aufnehmen“, weshalb die erste Box vollständig ist. Die Füllung muss daher mit den drei Kästchen oder Orbitalen auf der rechten Seite fortgesetzt werden.
Spin Paarung
Jede Box in der ersten Reihe hat einen Pfeil nach oben, der drei Elektronen mit Spins in die gleiche Richtung symbolisiert. Wenn sie nach oben zeigen, bedeutet dies, dass ihre Drehungen einen Wert von +1/2 haben. Wenn sie nach unten zeigen, haben ihre Drehungen Werte von -1/2.
Beachten Sie, dass die drei Elektronen unterschiedliche Orbitale besetzen, jedoch mit ungepaarte Drehungen.
In der dritten Reihe befindet sich das sechste Elektron mit einem Spin in die entgegengesetzte Richtung, -1/2. Dies ist bei der vierten Reihe nicht der Fall, bei der dieses Elektron mit einem Spin von +1/2 in das Orbital eintritt.
Und so werden die beiden Elektronen, wie die des ersten Orbitals, ihre haben gepaarte Spins (eine mit Spin +1/2 und eine mit Spin -1/2).
Die vierte Reihe von Kästchen oder Orbitalen verstößt gegen das Pauli-Ausschlussprinzip, wonach kein Elektron die gleichen vier Quantenzahlen haben kann. Hunds Regel und Paulis Ausschlussprinzip gehen immer Hand in Hand.
Daher sollten die Pfeile so platziert werden, dass sie ungepaart sind, bis sie alle Kisten belegen. und unmittelbar danach werden sie mit den Pfeilen vervollständigt, die in die entgegengesetzte Richtung zeigen.
Parallele und antiparallele Spins
Es reicht nicht aus, dass die Spins der Elektronen gepaart sind: Sie müssen auch parallel sein. Dies wird bei der Darstellung von Kästchen und Pfeilen gewährleistet, indem letztere mit ihren Enden parallel zueinander platziert werden..
Die zweite Reihe zeigt den Fehler, dass das Elektron in der dritten Box seinen Spin in einem antiparallelen Sinne in Bezug auf die anderen trifft..
Zusammenfassend lässt sich also zusammenfassen, dass der Grundzustand eines Atoms den Hundschen Regeln entspricht und daher die stabilste elektronische Struktur aufweist.
Die theoretische und experimentelle Grundlage bestätigt, dass ein Atom, wenn es Elektronen mit einer größeren Anzahl ungepaarter und paralleler Spins hat, sich infolge einer Zunahme der elektrostatischen Wechselwirkungen zwischen dem Kern und den Elektronen stabilisiert; Zunahme, die auf die Abnahme der Abschirmwirkung zurückzuführen ist.
Vielzahl
Das Wort "Vielfalt" wurde am Anfang erwähnt, aber was bedeutet es in diesem Zusammenhang? Die erste Regel von Hund besagt, dass der stabilste Grundzustand für ein Atom der mit der höchsten Anzahl an Spinmultiplizitäten ist. mit anderen Worten, das mit seinen Orbitalen mit der höchsten Anzahl ungepaarter Elektronen.
Die Formel zur Berechnung der Multiplizität des Spins lautet
2S + 1
Wobei S gleich der Anzahl ungepaarter Elektronen multipliziert mit 1/2 ist. Somit kann mit mehreren elektronischen Strukturen mit der gleichen Anzahl von Elektronen 2S + 1 für jede geschätzt werden und die mit dem höchsten Multiplizitätswert ist die stabilste..
Die Spinmultiplizität kann für die erste Reihe von Orbitalen mit drei Elektronen berechnet werden, deren Spins beispiellos und parallel sind:
S = 3 (1/2) = 3/2
Und die Vielfalt ist dann
2 (3/2) + 1 = 4
Dies ist Hunds erste Regel. Die stabilste Konfiguration muss auch anderen Parametern entsprechen, die jedoch zum Zwecke des chemischen Verständnisses nicht unbedingt erforderlich sind..
Ausbildung
Fluor
Es wird nur die Valenzschale berücksichtigt, da davon ausgegangen wird, dass die innere Schale bereits mit Elektronen gefüllt ist. Die Elektronenkonfiguration von Fluor ist daher [He] 2szwei2 P.5.
Ein 2s-Orbital muss zuerst gefüllt werden und dann drei p-Orbitale. Um das 2s-Orbital mit den beiden Elektronen zu füllen, reicht es aus, sie so zu platzieren, dass ihre Spins gepaart sind.
Die anderen fünf Elektronen für die drei 2p-Orbitale sind wie unten dargestellt angeordnet.
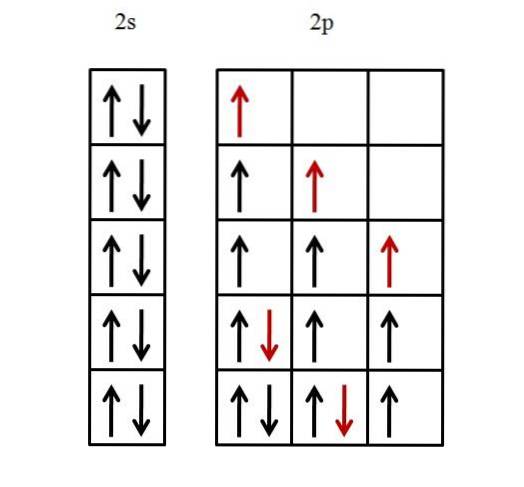
Der rote Pfeil repräsentiert das letzte Elektron, das die Orbitale füllt. Beachten Sie, dass die ersten drei Elektronen, die in die 2p-Orbitale eintreten, ungepaart und mit parallelen Spins platziert sind.
Dann beginnt es ab dem vierten Elektron, seinen Spin -1/2 mit dem anderen Elektron zu paaren. Das fünfte und letzte Elektron verlaufen auf die gleiche Weise.
Titan
Die Elektronenkonfiguration von Titan ist [Ar] 3dzwei4szwei. Da es fünf d-Orbitale gibt, wird empfohlen, auf der linken Seite zu beginnen:
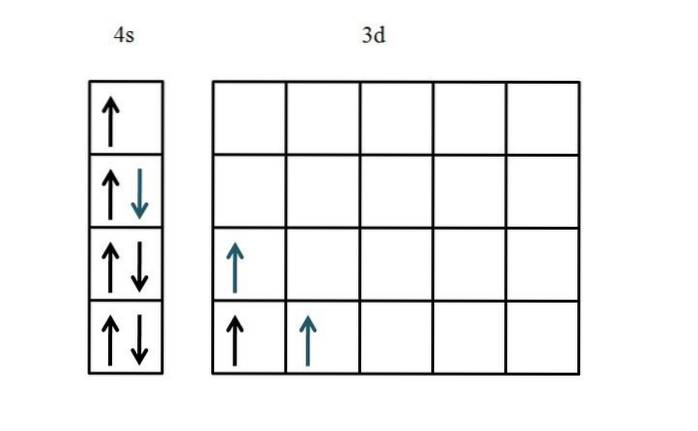
Diesmal wurde die Füllung des 4s-Orbitals gezeigt. Da die 3D-Orbitale nur zwei Elektronen enthalten, gibt es fast keine Probleme oder Verwirrung, wenn sie mit ihren ungepaarten und parallelen Spins platziert werden (blaue Pfeile)..
Eisen
Ein anderes Beispiel und schließlich Eisen ist ein Metall, das mehr Elektronen in seinen d-Orbitalen als Titan hat. Seine Elektronenkonfiguration ist [Ar] 3d64szwei.
Ohne Hunds Regel und das Pauli-Ausschlussprinzip würden wir nicht wissen, wie man solche sechs Elektronen in ihren fünf d-Orbitalen anordnet..
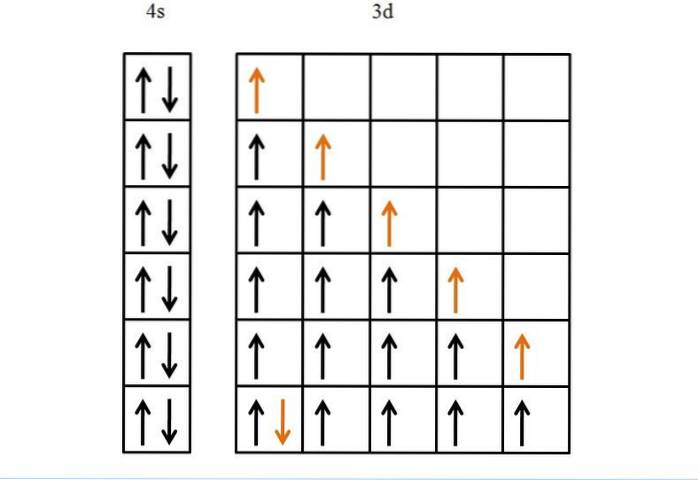
Obwohl es einfach erscheinen mag, könnten sich ohne diese Regeln viele falsche Möglichkeiten hinsichtlich der Reihenfolge des Füllens der Orbitale ergeben.
Dank dieser ist das Vorrücken des goldenen Pfeils logisch und eintönig, was nichts anderes als das letzte Elektron ist, das in den Orbitalen platziert wird..
Verweise
- Serway & Jewett. (2009). Physik: für Wissenschaft und Technik mit moderner Physik. Band 2. (Siebte Ausgabe). Lernen einbinden.
- Glasstone. (1970). Lehrbuch der physikalischen Chemie. Im Chemische Kinetik. Zweite Ausgabe. D. Van Nostrand, Company, Inc..
- Méndez A. (21. März 2012). Hunds Regel. Wiederhergestellt von: quimica.laguia2000.com
- Wikipedia. (2018). Hunds Regel der maximalen Multiplizität. Wiederhergestellt von: en.wikipedia.org
- Chemie LibreTexts. (23. August 2017). Hunds Regeln. Wiederhergestellt von: chem.libretexts.org
- Nave R. (2016). Hunds Regeln. Wiederhergestellt von: hyperphysics.phy-astr.gsu.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.