
Insulinrezeptoreigenschaften, Struktur, Funktionen
Das Insulinrezeptoren Sie sind Proteinstrukturen, die auf der extrazellulären Seite der Plasmamembran vieler Zellen des menschlichen Körpers und anderer Säugetiere exponiert sind. Der natürliche Ligand dieses Rezeptors ist Insulin.
Insulin ist ein Hormon, das von den ß-Zellen der Langerhans-Inseln des endokrinen Teils der Bauchspeicheldrüse synthetisiert wird, einem Organ in der Bauchhöhle, das Verdauungsenzyme und Hormone synthetisiert.
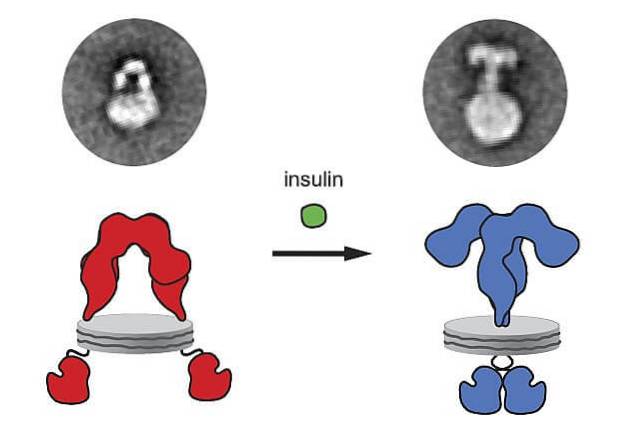
Das von der Bauchspeicheldrüse synthetisierte und freigesetzte Insulin bindet an seinen Rezeptor auf der Plasmamembran der Zielzellen, und als Folge dieser Ligand-Rezeptor-Bindung wird eine Reihe von intrazellulären Prozessen ausgelöst, die schließlich den Eintritt von Glucose in diese Zellen fördern..
Insulin ist für die Aktivierung vieler anaboler oder synthetischer Reaktionen verantwortlich, die mit dem Stoffwechsel von Kohlenhydraten, Fetten und Proteinen zusammenhängen..
Insulinrezeptoren sind Glykoproteine, die von vier Untereinheiten mit ihren Amino- und Carboxyl-terminalen Anteilen in der cytoplasmatischen Region gebildet werden. Wenn diese Rezeptoren an Insulin binden, verklumpen sie und Endozyten.
Bei Fettleibigkeit und Typ-II-Diabetes ist die Anzahl der Insulinrezeptoren verringert, was teilweise die Insulinresistenz erklärt, die mit diesen pathologischen Zuständen einhergeht.
Artikelverzeichnis
- 1 Funktionen
- 2 Struktur
- 3 Funktionen
- 4 Krankheiten
- 5 Referenzen
Eigenschaften
Insulinrezeptoren gehören zu einer Familie von Membranrezeptoren, die Bindungsstellen für Hormone proteiner Natur aufweisen. Diese Art von Hormonen kann Zellmembranen nicht durchqueren, so dass ihre metabolischen Wirkungen über ihre Rezeptoren ausgeführt werden..
Insulin ist ein Peptidhormon, das mit der Förderung synthetischer Reaktionen zusammenhängt, die zusammen als anabole Reaktionen bezeichnet werden und mit dem Stoffwechsel von Kohlenhydraten, Fetten und Proteinen zusammenhängen..
Viele Zellen haben Insulinrezeptoren, hauptsächlich Muskelzellen, Leberzellen und Fettgewebezellen. Andere Zellen, die anscheinend keine Insulin-Zielzellen sind, besitzen jedoch auch Insulinrezeptoren..
Der Eintritt von Glucose in Zellen in einigen Geweben hängt von Insulin ab, da in diesen die Proteine, die für die erleichterte Diffusion von Glucose verantwortlich sind, in kleinen Membranstücken gefunden werden, die intrazelluläre Vesikel bilden.
Wenn Insulin in dieser Art von insulinabhängigen Zellen an seinen Rezeptor bindet, bewegen sich die in den intrazellulären Vesikeln befindlichen Glucosetransporter und erscheinen auf der Oberfläche der Zellmembran, wenn diese Vesikel mit dieser Membran fusionieren..
Ein Beispiel für diesen Mechanismus sind unter anderem die Skelettmuskel- und Fettgewebezellen.
Insulinrezeptoren haben eine relativ kurze Halbwertszeit von etwa 7 bis 12 Stunden, so dass sie ständig synthetisiert und abgebaut werden. Bei Säugetieren beträgt die Rezeptorkonzentration ungefähr 20.000 Rezeptoren pro Zelle..
Wenn Insulin an den Rezeptor bindet, tritt eine Konformationsänderung des Rezeptors auf, benachbarte Rezeptoren bewegen sich, Mikroaggregate werden produziert und dann wird der Rezeptor internalisiert. Gleichzeitig werden die Signale erzeugt, die dann die Antworten verstärken..
Struktur
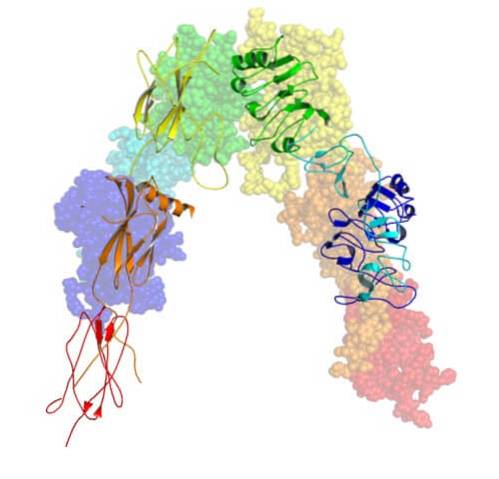
Das Gen, das für den Insulinrezeptor kodiert, befindet sich auf Chromosom 19 und hat 22 Exons. Dieser Rezeptor besteht aus vier Disulfid-verknüpften Glykoprotein-Untereinheiten..
Es wird im endoplasmatischen Retikulum zunächst als einzelne Polypeptidkette mit etwa 1.382 Aminosäuren synthetisiert, die dann phosphoryliert und gespalten wird, um die α- und β-Untereinheiten zu bilden..
Die vier Untereinheiten des Insulinrezeptors sind zwei Alphas (α) mit einem Molekulargewicht von 140.000 Da und zwei kleinere Betas (β) mit einem ungefähren Molekulargewicht von 95.000 Da.
Die α-Untereinheiten sind extrazellulär und liegen an der Außenfläche der Zellmembran frei. Die β-Untereinheiten durchqueren andererseits die Membran und legen die innere Oberfläche der Membran (gegenüber dem Zytoplasma) frei oder ragen heraus..
Die α-Untereinheiten enthalten die Bindungsstelle für Insulin. In den β-Einheiten gibt es eine Bindungsstelle für ATP, die die Kinasefunktion dieser Untereinheit aktiviert und die Rezeptorautophosphorylierung an den Tyrosinresten der β-Untereinheit induziert..
Diese Rezeptoren gehören zu einer Familie von Rezeptoren, die mit zytoplasmatischen Enzymen wie Tyrosinkinase assoziiert sind. Dieses Enzym wird aktiviert, wenn Insulin an den Rezeptor bindet und einen Prozess der Phosphorylierung und Dephosphorylierung einer Reihe von Enzymen initiiert, die für die Auswirkungen verantwortlich sind Insulin metabolisch.
Eigenschaften
Die α-Untereinheit der Insulinrezeptoren hat die Bindungsstelle für Insulin. Wenn diese Einheit an ihren Liganden bindet, treten Konformationsänderungen in der Rezeptorstruktur auf, die die β-Untereinheiten aktivieren, die für die Signaltransduktionsmechanismen und damit für die Wirkungen von Insulin verantwortlich sind..
In den cytoplasmatischen Domänen des Rezeptors wird eine Tyrosinkinase aktiviert, die die Übertragung von Signalen durch eine Kaskade von Kinasen initiiert. Das erste, was passiert, ist die Phosphorylierung oder Autophosphorylierung des Insulinrezeptors, und dann werden die sogenannten Insulinrezeptorsubstrate oder IRS phosphoryliert..
Es wurden vier Insulinrezeptorsubstrate mit den Bezeichnungen IRS-1, IRS-2, IRS-3 und IRS-4 beschrieben. Ihre Phosphorylierung erfolgt an Tyrosin-, Serin- und Threoninresten. Jedes dieser Substrate ist mit verschiedenen Kinasekaskaden verwandt, die an den metabolischen Wirkungen von Insulin beteiligt sind..
Beispielsweise:
- IRS-1 scheint mit der Wirkung von Insulin auf das Zellwachstum in Zusammenhang zu stehen.
- IRS-2 stehen im Zusammenhang mit den metabolischen Wirkungen des Hormons wie der erhöhten Synthese von Glykogen, Lipiden und Proteinen und der Translokation von Proteinen wie Rezeptorproteinen und Glukosetransportproteinen..
Krankheiten
Diabetes ist eine Krankheit, die einen sehr hohen Prozentsatz der Weltbevölkerung betrifft und mit Defekten bei der Insulinproduktion, aber auch mit einer mangelhaften Funktion der Insulinrezeptoren zusammenhängt.
Es gibt zwei Arten von Diabetes: Typ-I-Diabetes oder Jugenddiabetes, der insulinabhängig ist, und Typ-II-Diabetes oder Diabetes bei Erwachsenen, der nicht insulinabhängig ist..
Typ-I-Diabetes ist auf eine unzureichende Insulinproduktion zurückzuführen und geht mit Hyperglykämie und Ketoazidose einher. Typ-II-Diabetes hängt mit genetischen Faktoren zusammen, die sowohl die Insulinproduktion als auch die Rezeptorfunktion beeinflussen, und ist mit Hyperglykämie ohne Ketoazidose verbunden.
Verweise
- American Diabetes Association. (2010). Diagnose und Klassifizierung von Diabetes mellitus. Diabetes Care, 33 (Ergänzung 1), S62-S69.
- Bern, R. & Levy, M. (1990). Physiologie. Mosby; Internationale Ed-Ausgabe.
- Fox, S. I. (2006). Humanphysiologie (9. Aufl.). New York, USA: McGraw-Hill Press.
- Guyton, A. & Hall, J. (2006). Lehrbuch der Medizinischen Physiologie (11. Aufl.). Elsevier Inc..
- Lee, J. & Pilch, P. F. (1994). Der Insulinrezeptor: Struktur, Funktion und Signalgebung. American Journal of Physiology-Cell Physiology, 266 (2), C319-C334.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.