
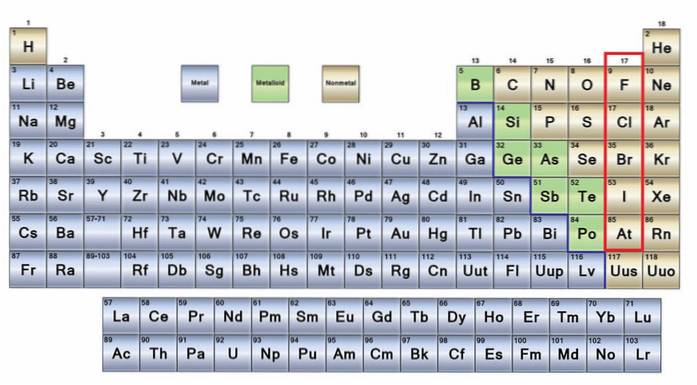
Nichtmetallhistorie, Eigenschaften, Gruppen, Verwendungen
Das keine Metalle Sie sind eine Gruppe von Elementen, die sich auf der rechten Seite des Periodensystems befinden, mit Ausnahme von Wasserstoff, der sich in Gruppe 1 (IA) befindet, zusammen mit den Alkalimetallen. Wenn Sie wissen möchten, was sie sind, müssen Sie in die obere rechte Ecke des p-Blocks schauen.
Nichtmetallatome sind relativ klein und ihre äußere elektronische Hülle weist eine hohe Anzahl von Elektronen auf. Unter den nichtmetallischen Elementen können Feststoffe, Flüssigkeiten und Gase sein; Obwohl sich die meisten von ihnen in einem gasförmigen Zustand befinden, bereichern einige von ihnen die Atmosphäre.
Ein großer Teil der Nichtmetalle ist in allen Lebewesen in Form von Verbindungen und Makromolekülen vorhanden. Zum Beispiel: Kohlenstoff, Sauerstoff und Wasserstoff sind in allen Proteinen, Lipiden, Kohlenhydraten und Nukleinsäuren enthalten.
Phosphor ist in allen Nukleinsäuren sowie in einigen Kohlenhydraten und Lipiden vorhanden. Schwefel kommt in vielen Proteinen vor. Stickstoff ist Teil aller Nukleinsäuren und Proteine.
Andererseits bestehen Methangase und Rohöl im Untergrund fast ausschließlich aus nichtmetallischen Elementen. Tatsächlich geben Kohlenwasserstoffe (Kohlenstoff und Wasserstoff) eine Vorstellung davon, wie häufig Nichtmetalle trotz ihrer geringeren Anzahl von Elementen im Periodensystem vorhanden sind..
Artikelverzeichnis
- 1 Geschichte
- 2 Physikalische und chemische Eigenschaften
- 2.1 Physik
- 2.2 Chemie
- 3 Gruppen von Nichtmetallen und Elementen
- 3.1 Gruppe 1
- 3.2 Gruppe 14
- 3.3 Gruppe 15
- 3.4 Gruppe 16
- 3.5 Gruppe 17
- 3.6 Gruppe 18
- 4 Verwendungen
- 4.1 Wasserstoff
- 4.2 Kohlenstoff
- 4.3 Stickstoff
- 4.4 Phosphor
- 4.5 Sauerstoff
- 4.6 Schwefel
- 4.7 Selen
- 4.8 Fluor
- 4.9 Chlor
- 4.10 Brom
- 4.11 Jod
- 4.12 Helium
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referenzen
Geschichte
Seit der Antike (3750 v. Chr.) Verwendeten die Ägypter Kohle, um das in ihren Mineralien wie Korvellit und Malachit enthaltene Kupfer zu reduzieren.
1669 gelang es Hennin Brand, Phosphor aus gesammeltem Urin zu isolieren. Henry Cavendish (1776) gelang es, Wasserstoff zu identifizieren, obwohl mehrere Forscher, darunter Robert Boyle (1670), Wasserstoff durch Reaktion einer starken Säure mit einem Metall produzierten.
Carl Scheele produzierte Sauerstoff durch Erhitzen von Quecksilberoxid mit Nitraten (1771). Curtois gelang es, Jod zu isolieren, während er versuchte, Salpeter aus Seetang herzustellen (1811). Balard und Gmelin isolierten Brom (1825).
Im Jahr 1868 entdeckten Janssen und Lockger unabhängig voneinander Helium, indem sie bei der Untersuchung des Spektrums des Sonnenlichts, das nicht zu einem anderen Element gehörte, eine gelbe Linie beobachteten. Moissan gelang es, Fluorid zu isolieren (1886).
1894 entdeckten Lord Rayleigh und Ramsey Argon, indem sie die Eigenschaften von Stickstoff untersuchten. Ramsay und Travers (1898) isolierten Krypton, Neon und Xenon aus flüssigem Argon durch kryogene Destillation von Luft..
Physikalische und chemische Eigenschaften

Körperlich
Einige der physikalischen Eigenschaften von Nichtmetallen sind:
-Sie haben eine geringe elektrische Leitfähigkeit, mit Ausnahme von Kohlenstoff in Form von Graphit, der ein guter Stromleiter ist..
-Sie können unter der physikalischen Erscheinung von Feststoffen, Flüssigkeiten oder Gasen auftreten.
-Sie haben eine geringe Wärmeleitfähigkeit, mit Ausnahme von Kohlenstoff in Form von Diamant, der sich nicht als Wärmeisolator verhält..
-Sie haben im Gegensatz zum metallischen Glanz von Metallen einen geringen Glanz.
-Nichtmetallische Feststoffe sind spröde und daher nicht duktil oder formbar.
-Sie haben niedrige Schmelz- und Siedepunkte.
-Sie können unterschiedliche kristalline Strukturen haben. Somit haben Phosphor, Sauerstoff und Fluor eine kubische Kristallstruktur; Wasserstoff, Kohlenstoff und Stickstoff, hexagonal; und Schwefel, Chlor, Brom und Jod, orthorhombisch.
Chemie
Nichtmetalle zeichnen sich durch eine hohe Ionisierungsenergie und einen hohen Elektronegativitätswert aus. Fluor hat zum Beispiel die höchste Elektronegativität (3,98) und ist das reaktivste Element der Nichtmetalle.
Überraschenderweise weisen die Edelgase Helium (5,5) und Neon (4,84) die höchste Elektronegativität auf. Sie sind jedoch chemisch inert, da die äußeren elektronischen Hüllen gefüllt sind..
Nichtmetalle bilden mit Metallen ionische Verbindungen und mit Nichtmetallen kovalent.
Es wird gefunden, dass nichtmetallische Elemente zweiatomige Moleküle bilden, die durch kovalente Bindungen verbunden sind. Inzwischen liegen die Atome der Edelgase in Form von Atomeinheiten vor.
Sie bilden saure Oxide, die bei Reaktion mit Wasser zu Säuren führen.
Nichtmetallgruppen und -elemente
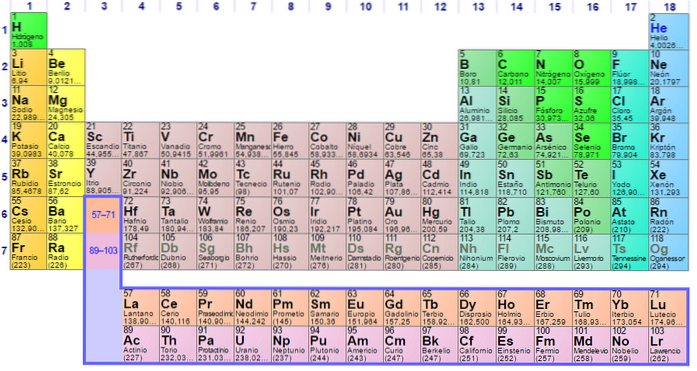
Gruppe 1
Es besteht aus Wasserstoff, einem farblosen und geruchlosen Gas, zweiatomig. Oxidationsstufe +1. Es hat eine geringere Dichte als Luft. Im festen Zustand hat es eine hexagonale Kristallstruktur. Wasserstoff ist ein schlecht reaktives Element.
Gruppe 14
Kohlenstoff ist das einzige Nichtmetall in dieser Gruppe. Kohlenstoff in Form von Graphit ist ein glänzender Feststoff mit einer hexagonalen Kristallstruktur. Es hat eine hohe elektrische Leitfähigkeit. Die häufigsten Oxidationsstufen sind +2 und +4.
Gruppe 15
Stickstoff
Farbloses und geruchloses Gas. Es ist ein leicht reaktives Element und etwas dichter als Luft. Häufigste Oxidationsstufen: -3 und +5. Bildet zweiatomige Moleküle, N.zwei.
Spiel
Fest, seine Farbe kann weiß, gelb oder schwarz sein. Wenig reaktiv. Orthorhombische Kristallstruktur. Elektronegativität 2.1. Häufigste Oxidationsstufen: -3 und +5.
Gruppe 16
Sauerstoff
Farbloses oder hellblaues Gas, geruchlos. Im Allgemeinen nicht reaktiv. Kubische Kristallstruktur. Es ist ein Isolator und ein starkes Oxidationsmittel. Elektronegativität 3.5. Oxidationszustand -2
Schwefel
Brillanter gelber Feststoff, spröde, mäßig reaktiv. Orthorhombische Kristallstruktur. Bildet kovalente Bindungen. Elektronegativität 2.5. Häufigste Oxidationsstufen: -2, +2, +4 und +6.
Selen
Festes Grau oder rötlich bis schwarz. Graues Selen weist eine lichtempfindliche elektrische Leitfähigkeit auf. Es ist ein weicher und spröder Feststoff. Elektronegativität 2.4. Oxidationsstufen: -2, +2, +4 und +6.
Gruppe 17
Fluor
Es ist ein hellgelbes Gas, sehr giftig. Es ist ein sehr reaktives Element. Es kommt als zweiatomige Moleküle vor, F.zwei. Im festen Zustand kristallisiert es in kubischer Form. Elektronegativität 3.98. Oxidationsstufen -1.
Chlor
Es ist ein grün-gelbes Gas. Es präsentiert zweiatomige Moleküle, Clzwei. Es ist sehr reaktiv. Im festen Zustand ist die Kristallstruktur orthorhombisch. Elektronegativität 3.0. Oxidationsstufen: - 1, +1, +3, +5, +7.
Brom
Es ist eine rotbraune Flüssigkeit. Elektronegativität 2.8. Oxidationsstufen -1, +1, +3, +5 und +7.
Jod
Es ist ein schwarzer Feststoff, der bei Sublimation einen violetten Dampf abgibt. Orthorhombische Kristallstruktur. Metalliodide sind ionisch. Elektronegativität 2.5. Oxidationsstufen: -1, +1, +3, +5 und +7.
Astatus
Es ist ein festes Schwarz. Gesichtszentrierte kubische Kristallstruktur. Elektronegativität 2.2. Es ist ein schwaches Oxidationsmittel.
Gruppe 18
Helium
Es hat eine hohe Wärmeleitfähigkeit. Elektronegativität 5.5. Es ist chemisch inert und nicht brennbar. Geringe Dichte und hohe Fließfähigkeit.
Neon
Hohe Kühlleistung im flüssigen Zustand. Elektronegativität 4.84. Es ist das am wenigsten reaktive der Edelgase.
Argon
Es ist dichter als Luft. Chemisch inert. Elektronegativität 3.2.
Krypton
Elektronegativität 2.94. Kann mit Fluor unter Bildung von Krypton-Difluorid (KrF) reagierenzwei).
Xenon
Es überquert die Blut-Hirn-Schranke. Es reagiert auf elektrischen Strom, indem es Licht erzeugt. Elektronegativität 2.2. Bildet mit Fluor, Gold und Sauerstoff Komplexe.
Radon
Es ist ein radioaktives Element. Elektronegativität 2.06. Bildet mit Fluor (RnF) Verbindungenzwei) und mit Sauerstoff (RnO3).
Anwendungen
Wasserstoff
Es wird beim Raketenantrieb und als Kraftstoff in Automotoren verwendet, die Wasserstoff verwenden. Es wird zur Synthese von Ammoniak (NH) verwendet3) und bei der Hydrierung von Fetten.
Kohlenstoff

Graphit wird zur Herstellung von Stiften und hochfesten Fasern verwendet, die zur Herstellung von Sportartikeln verwendet werden. Diamant wird als Edelstein von großem Wert und in Bohrlöchern als Schleifmittel verwendet. Kohlendioxid wird zur Herstellung von kohlensäurehaltigen Getränken verwendet.
Stickstoff
Es wird zur Herstellung von Ammoniak, Salpetersäure und Harnstoff verwendet. Stickstoff ist ein wesentliches Element für Pflanzen und wird zur Herstellung von Düngemitteln verwendet.
Spiel
Weißer Phosphor wird als Rodentizid, Insektizid und in der Feuerwerksindustrie verwendet. Roter Phosphor wird verwendet, um Streichhölzer herzustellen. Seine Verbindungen werden auch zur Herstellung von Düngemitteln verwendet.
Sauerstoff
Sauerstoff wird zur Herstellung von Stahl, Kunststoffen und Textilien verwendet. Es wird auch in Raketentreibstoffen, zur Sauerstofftherapie und zur Atemunterstützung in Flugzeugen, U-Booten und in der Raumfahrt eingesetzt..
Schwefel
Es wird als Rohstoff für die Herstellung von Schwefelsäure, Schießpulver und bei der Vulkanisation von Kautschuken verwendet. Sulfite werden zum Bleichen von Papier und in Fungiziden verwendet.
Selen
Es wird verwendet, um Glas einen scharlachroten Farbton zu verleihen. Es wird auch verwendet, um den grünlichen Schimmer zu neutralisieren, der durch Verunreinigung des Glases mit Eisenverbindungen entsteht. Es wird in Fotozellen mit Anwendung in Türen und Aufzügen eingesetzt.
Fluor

Es wird Zahnpasten zugesetzt, um Hohlräume zu vermeiden. Fluorwasserstoff wird als Rohstoff für Teflon verwendet. Monatomisches Fluor wird zur Herstellung von Halbleitern verwendet.
Chlor
Es wird in der extraktiven Metallurgie und bei der Chlorierung von Kohlenwasserstoffen zur Herstellung verschiedener Produkte wie PVC verwendet. Chlor wird in Zellstoff- und Textilbleichmitteln verwendet. Es wird auch als Wasserdesinfektionsmittel verwendet.
Brom
Es wird zur Herstellung von Silberbromid für lichtempfindliche Linsen und für fotografische Filme verwendet. Es wird auch zur Herstellung des Beruhigungsmittels Natriumbromid und Dibromethan verwendet, einer Antiklopfkomponente von Benzin.
Jod
Kaliumjodid (KI) wird hinzugefügt, um Schilddrüsenkropf zu verhindern. Jodtinktur wird als Antiseptikum und Germizid verwendet. Jod ist Teil der Schilddrüsenhormone.
Helium
Es wird zum Befüllen von Heißluftballons verwendet und mit Sauerstoff für die Tiefwasseratmung gemischt. Es wird zum Schweißen in einer inerten Atmosphäre verwendet und trägt auch dazu bei, sehr niedrige Temperaturen in der Forschung aufrechtzuerhalten.
Neon
In Glasröhren, die durch Einwirkung von Elektrizität beleuchtet werden (rote Neonlichter).
Argon
Wird verwendet, um eine Atmosphäre zum Schweißen und zum Befüllen von Glühlampen zu schaffen.
Xenon
Eine Mischung aus Xenon und Krypton wird zur Erzeugung von Blitzen hoher Intensität bei kurzen fotografischen Belichtungen verwendet.
Radon
Es wird zur Behandlung von Krebstumoren durch Strahlentherapie eingesetzt.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- C. K. Mathews, K. E. van Holde und K. G. Ahern (2002). Biochemie. Dritte Edition. Bearbeiten. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06. Oktober 2019). Was sind die Eigenschaften von Nichtmetallen? Wiederhergestellt von :oughtco.com
- Wikipedia. (2019). Nichtmetall. Wiederhergestellt von: en.wikipedia.org
- Die Herausgeber der Encyclopaedia Britannica. (5. April 2016). Nichtmetall. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- José M. Gavira Vallejo. (2016, 27. Januar). Was sind die polygenen Elemente? Und die Ikosagene, die Kristallgene, die Chalkogene ...? Wiederhergestellt von: triplenlace.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.