
Fluor Geschichte, Eigenschaften, Struktur, Gewinnung, Risiken, Verwendungen
Das Fluor Es ist ein chemisches Element, das durch das Symbol F und die Kopfgruppe 17 dargestellt wird, zu der Halogene gehören. Es unterscheidet sich über den anderen Elementen des Periodensystems als das reaktivste und elektronegativste; reagiert mit fast allen Atomen und bildet so unzählige Salze und organofluorierte Verbindungen.
Unter normalen Bedingungen ist es ein blassgelbes Gas, das mit gelblichgrün verwechselt werden kann. Im flüssigen Zustand, wie im Bild unten gezeigt, verstärkt sich seine gelbe Farbe etwas mehr, die vollständig verschwindet, wenn sie sich an ihrem Gefrierpunkt verfestigt..

Trotz der Flüchtigkeit seines Gases ist seine Reaktivität so groß, dass es in der Erdkruste eingeschlossen bleibt. insbesondere in Form des Minerals Fluorit, bekannt für seine violetten Kristalle. Ebenso macht seine Reaktivität es zu einer potenziell gefährlichen Substanz; reagiert heftig auf alles, was es berührt und in Flammen brennt.
Viele seiner Nebenprodukte können jedoch je nach Anwendung harmlos und sogar vorteilhaft sein. Die beliebteste Verwendung von Fluorid, das in ionischer oder mineralischer Form (wie Fluoridsalze) zugesetzt wird, ist beispielsweise die Herstellung von Fluorid-Zahnpasten, die zum Schutz des Zahnschmelzes beitragen..
Fluor hat die Besonderheit, dass es die hohen Zahlen oder Oxidationsstufen für viele andere Elemente stabilisieren kann. Je höher die Anzahl der Fluoratome ist, desto reaktiver ist die Verbindung (es sei denn, es handelt sich um ein Polymer). Ebenso werden seine Wirkungen mit molekularen Matrizen zunehmen; wohl oder übel.
Artikelverzeichnis
- 1 Geschichte
- 1.1 Verwendung von Fluorit
- 1.2 Herstellung von Flusssäure
- 1.3 Isolierung
- 1.4 Interesse an Fluorid
- 2 Physikalische und chemische Eigenschaften
- 2.1 Aussehen
- 2.2 Ordnungszahl (Z)
- 2.3 Atomgewicht
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Dichte
- 2.7 Verdampfungswärme
- 2,8 Molare Wärmekapazität
- 2.9 Dampfdruck
- 2.10 Wärmeleitfähigkeit
- 2.11 Magnetische Ordnung
- 2.12 Geruch
- 2.13 Oxidationszahlen
- 2.14 Ionisierungsenergie
- 2.15 Elektronegativität
- 2.16 Oxidationsmittel
- 2.17 Reaktivität
- 3 Aufbau und elektronische Konfiguration
- 3.1 Diatomeenmolekül
- 3.2 Flüssig und fest
- 4 Wo zu finden und zu erhalten
- 4.1 Fluoritverarbeitung
- 4.2 Elektrolyse von Fluorwasserstoff
- 5 Isotope
- 6 Biologische Rolle
- 7 Risiken
- 7.1 Zahnfluorose
- 7.2 Skelettfluorose
- 8 Verwendungen
- 8.1 Zahnpasten
- 8.2 Wasserfluoridierung
- 8.3 Oxidationsmittel
- 8.4 Polymere
- 8.5 Apotheker
- 8.6 Glasätzen
- 8.7 Anreicherung von Uran
- 9 Referenzen
Geschichte
Verwendung von Fluorit
1530 entdeckte der deutsche Mineralogist Georgius Agricola, dass das Mineral Flussspat zur Reinigung von Metallen verwendet werden kann. Flussspat ist ein anderer Name für Fluorit, ein Fluormineral, das aus Calciumfluorid (CaF) bestandzwei).
Das Element Fluor war bis dahin noch nicht entdeckt worden, und das "Fluoir" in Fluorit kam vom lateinischen Wort "Fluere", was "fließen" bedeutet. denn genau das tat Flussspat oder Fluorit mit Metallen: Es half ihnen, die Probe zu verlassen.
Herstellung von Flusssäure
1764 gelang es Andreas Sigismud Margraff, Flusssäure herzustellen und Fluorit mit Schwefelsäure zu erhitzen. Die Glasretorten wurden durch die Einwirkung der Säure geschmolzen, so dass das Glas durch Metalle ersetzt wurde.
Es wird auch Carl Scheele im Jahre 1771 zugeschrieben, der Herstellung der Säure nach der gleichen Methode, gefolgt von Margraff. 1809 schlug der französische Wissenschaftler Andre-Marie Ampere vor, dass Fluor- oder Flusssäure eine Verbindung aus Wasserstoff und einem neuen chlorähnlichen Element sei..
Wissenschaftler versuchten lange Zeit, Fluorid unter Verwendung von Flusssäure zu isolieren; aber seine Gefährlichkeit machte Fortschritte in diesem Sinne schwierig.
Humphry Davy, Joseph Louis Gay-Lussac und Jacques Thénard hatten starke Schmerzen beim Einatmen von Fluorwasserstoff (Flusssäure ohne Wasser und in gasförmiger Form). Die Wissenschaftler Paulin Louyet und Jerome Nickles starben unter ähnlichen Umständen an einer Vergiftung.
Edmond Frémy, ein französischer Forscher, versuchte, durch Ansäuern von Kaliumbifluorid (KHF) trockene Flusssäure herzustellen, um eine Fluorwasserstofftoxizität zu vermeidenzwei), aber während der Elektrolyse gab es keine Leitung des elektrischen Stroms.
Isolation
1860 versuchte der englische Chemiker George Gore die Elektrolyse von trockener Flusssäure und gelang es, eine kleine Menge des Fluorgases zu isolieren. Es kam jedoch zu einer Explosion, als Wasserstoff und Fluor heftig rekombinierten. Gore führte die Explosion auf ein Sauerstoffleck zurück..
1886 gelang es dem französischen Chemiker Henri Moisson erstmals, Fluor zu isolieren. Zuvor wurde Moissons Arbeit viermal durch eine schwere Fluorwasserstoffvergiftung unterbrochen, während versucht wurde, das Element zu isolieren..
Moisson war ein Schüler von Frémy und verließ sich auf seine Experimente, um Fluor zu isolieren. Moisson verwendete bei der Elektrolyse eine Mischung aus Kaliumfluorid und Flusssäure. Die resultierende Lösung leitete Elektrizität und Fluorgas, die an der Anode gesammelt wurden; das heißt, an der positiv geladenen Elektrode.
Moisson verwendete korrosionsbeständige Geräte, bei denen die Elektroden aus einer Legierung aus Platin und Iridium hergestellt waren. Bei der Elektrolyse verwendete er einen Platinbehälter und kühlte die Elektrolytlösung auf eine Temperatur von -31ºC ab..
Am 26. Juni 1886 gelang es Henri Moissson schließlich, Fluor zu isolieren, was ihm 1906 den Nobelpreis ermöglichte.
Interesse an Fluorid
Das Interesse an der Fluoridforschung ging zeitweise verloren. Die Entwicklung des Manhattan-Projekts zur Herstellung der Atombombe hat es jedoch erneut angekurbelt.
Das amerikanische Unternehmen Dupont entwickelte zwischen 1930 und 1940 fluorierte Produkte wie Fluorchlorkohlenwasserstoffe (Freon-12), die als Kältemittel verwendet werden. und Polytetrafluorethylen-Kunststoff, besser bekannt unter dem Namen Teflon. Dies führte zu einer Erhöhung der Produktion und des Verbrauchs von Fluorid..
1986 stellte der amerikanische Chemiker Karl O. Christe auf einer Konferenz etwa ein Jahrhundert nach der Isolierung von Fluor eine chemische Methode zur Herstellung von Fluor durch die Reaktion zwischen K vorzweiMnF6 und die SbF5.
Physikalische und chemische Eigenschaften
Aussehen
Fluor ist ein hellgelbes Gas. Im flüssigen Zustand ist es hellgelb. In der Zwischenzeit kann der Feststoff undurchsichtig (Alpha) oder transparent (Beta) sein..
Ordnungszahl (Z)
9.
Atomares Gewicht
18.998 u.
Schmelzpunkt
-219,67 ºC.
Siedepunkt
-188,11 ºC.
Dichte
Bei Raumtemperatur: 1,696 g / l.
Am Schmelzpunkt (flüssig): 1,505 g / ml.
Verdampfungswärme
6,51 kJ / mol.
Molare Wärmekapazität
31 J / (mol K).
Dampfdruck
Bei einer Temperatur von 58 K hat es einen Dampfdruck von 986,92 atm.
Wärmeleitfähigkeit
0,0277 W / (m K)
Magnetische Ordnung
Diamagnetisch
Geruch
Charakteristischer stechender und stechender Geruch, der bereits bei 20 ppb nachweisbar ist.
Oxidationszahlen
-1, die dem Fluoridanion F entspricht-.
Ionisationsenergie
-Erstens: 1.681 kJ / mol
-Zweitens: 3.374 kJ / mol
-Drittens: 6.147 KJ / mol
Elektronegativität
3,98 auf der Pauling-Skala.
Es ist das chemische Element mit den höchsten Elektronegativitäten; das heißt, es hat eine hohe Affinität zu den Elektronen der Atome, mit denen es sich verbindet. Aus diesem Grund erzeugen Fluoratome in bestimmten Regionen eines Moleküls große Dipolmomente..
Seine Elektronegativität hat noch einen weiteren Effekt: Die daran gebundenen Atome verlieren so viel Elektronendichte, dass sie beginnen, eine positive Ladung zu erhalten; Dies ist eine positive Oxidationszahl. Je mehr Fluoratome sich in einer Verbindung befinden, desto positiver ist die Oxidationszahl des Zentralatoms..
Zum Beispiel im OFzwei Sauerstoff hat eine Oxidationszahl von +2 (O.zwei+F.zwei-); in der UF6, Uran hat eine Oxidationszahl von +6 (U.6+F.6-); das gleiche passiert mit Schwefel in SF6 (S.6+F.6-); und schließlich gibt es die AgFzwei, wo Silber sogar eine Oxidationszahl von +2 hat, selten dafür.
Daher können die Elemente mit ihren positivsten Oxidationszahlen teilnehmen, wenn sie mit Fluor Verbindungen bilden..
Oxidationsmittel
Fluor ist das stärkste oxidierende Element, daher kann es keine Substanz oxidieren. und aus diesem Grund ist es in der Natur nicht frei zu finden.
Reaktivität
Fluor kann sich mit allen anderen Elementen außer Helium, Neon und Argon verbinden. Bei normalen Temperaturen greift es auch keinen Weichstahl oder Kupfer an. Reagiert heftig mit organischen Materialien wie Gummi, Holz und Stoff.
Fluor kann mit dem Edelgas Xenon unter Bildung des starken Oxidationsmittels Xenondifluorid XeF reagierenzwei. Es reagiert auch mit Wasserstoff unter Bildung eines Halogenids, Fluorwasserstoffs, HF. Fluorwasserstoff löst sich wiederum in Wasser unter Bildung der berühmten Flusssäure (als Glas)..
Der Säuregehalt der sauren Säuren, in aufsteigender Reihenfolge klassifiziert, ist:
HF < HCl < HBr < HI
Salpetersäure reagiert mit Fluor unter Bildung von Fluornitrat, FNO3. Währenddessen reagiert Salzsäure heftig mit Fluor unter Bildung von HF, OFzwei und ClF3.
Struktur und elektronische Konfiguration

Diatomeenmolekül

Das Fluoratom hat im Grundzustand sieben Valenzelektronen, die sich je nach elektronischer Konfiguration in den 2s- und 2p-Orbitalen befinden:
[Er] 2szwei 2 P.5
Die Valenzbindungstheorie (VTE) besagt, dass zwei Fluoratome, F, kovalent gebunden sind, um jeweils ihr Valenzoktett zu vervollständigen.
Dies geschieht schnell, da nur ein Elektron benötigt wird, um für das Neon-Edelgas isoelektronisch zu werden. und seine Atome sind sehr klein, mit einer sehr starken effektiven Kernladung, die leicht Elektronen aus der Umgebung benötigt.
Das Molekül F.zwei (oberes Bild) hat eine einfache kovalente Bindung, F-F. Trotz seiner Stabilität im Vergleich zu freien F-Atomen ist es ein hochreaktives Molekül; homonuklear, unpolar und begierig auf Elektronen. Deshalb ist Fluor wie F.zwei, Es ist eine sehr giftige und gefährliche Art.
Weil der F.zwei ist unpolar, seine Wechselwirkungen hängen von seiner Molekülmasse und den Londoner Streukräften ab. Irgendwann muss sich die elektronische Wolke um beide F-Atome verformen und einen augenblicklichen Dipol erzeugen, der einen anderen in einem benachbarten Molekül induziert. so dass sie sich langsam und schwach anziehen.
Flüssig und fest
Das Molekül F.zwei es ist sehr klein und diffundiert relativ schnell in den Weltraum. In seiner Gasphase zeigt es eine hellgelbe Farbe (die mit einem Limonengrün verwechselt werden kann). Wenn die Temperatur auf -188 ºC abfällt, werden die Dispersionskräfte wirksamer und bilden die F-Molekülezwei verschmelzen genug, um eine Flüssigkeit zu definieren.
Flüssiges Fluor (erstes Bild) sieht noch gelber aus als das jeweilige Gas. Darin sind die Moleküle F.zwei Sie sind näher und interagieren stärker mit Licht. Interessanterweise verblasst die Farbe und bleibt als transparenter Feststoff erhalten, sobald sich der verzerrte kubische Fluorkristall bei -220 ° C bildet..
Nun, da die F-Molekülezwei sind so nah (aber ohne dass ihre molekularen Rotationen aufhören), dass es scheint, dass ihre Elektronen eine gewisse Stabilität erlangen und daher ihr elektronischer Sprung zu groß ist, als dass das Licht überhaupt mit dem Kristall interagieren könnte.
Kristalline Phasen
Dieser kubische Kristall entspricht der β-Phase (er ist kein Allotrop, da er immer noch das gleiche F istzwei). Wenn die Temperatur noch weiter auf -228 ºC abfällt, durchläuft das feste Fluor einen Phasenübergang; Der kubische Kristall wird monoklin, die α-Phase:
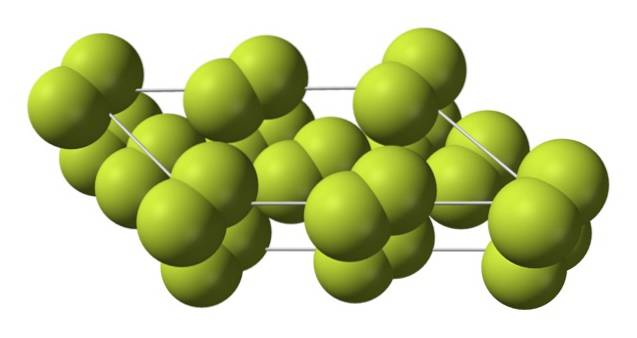
Im Gegensatz zu β-Fzwei, das α-Fzwei es ist undurchsichtig und hart. Vielleicht liegt es an den F-Molekülenzwei Sie haben nicht mehr so viel Freiheit, sich in ihren festen Positionen auf monoklinen Kristallen zu drehen. wo sie in größerem Maße mit Licht interagieren, ohne jedoch ihre Elektronen anzuregen (was ihre Opazität oberflächlich erklären würde).
Die Kristallstruktur von α-Fzwei Es war schwierig, mit herkömmlichen Röntgenbeugungsmethoden zu untersuchen. Dies liegt daran, dass der Übergang von der β- zur α-Phase stark exotherm ist. so explodierte der Kristall praktisch, während er wenig Wechselwirkung mit Strahlung hatte.
Es dauerte ungefähr fünfzig Jahre, bis deutsche Wissenschaftler (Florian Kraus et al.) Die Struktur von α-F vollständig entschlüsselt hattenzwei genauer gesagt dank Neutronenbeugungstechniken.
Wo zu finden und zu erhalten
Fluor belegt den 24. Platz unter den häufigsten Elementen im Universum. Auf der Erde ist es jedoch Masse 13vo Element mit einer Konzentration von 950 ppm in der Erdkruste und einer Konzentration von 1,3 ppm im Meerwasser.
Böden haben eine Fluoridkonzentration zwischen 150 und 400 ppm, und in einigen Böden kann die Konzentration 1.000 ppm erreichen. In atmosphärischer Luft liegt es in einer Konzentration von 0,6 ppb vor; In einigen Städten wurden jedoch bis zu 50 ppb registriert.
Fluor wird hauptsächlich aus drei Mineralien gewonnen: Fluorit oder Fluorspar (CaF)zwei), Fluorapatit [Ca.5(PO4)3F] und Kryolith (Na3AlF6).
Fluoritverarbeitung
Nach dem Sammeln der Gesteine mit dem Mineral Fluorit werden sie primär und sekundär zerkleinert. Beim sekundären Zerkleinern werden sehr kleine Gesteinsfragmente erhalten.
Die Gesteinsfragmente werden dann zur Reduktion zu Pulver in eine Kugelmühle gebracht. Wasser und Reagenzien werden zu einer Paste hinzugefügt, die in einen Flotationstank gegeben wird. Luft wird unter Druck eingespritzt, um Blasen zu bilden, und somit schwimmt der Fluorit auf der wässrigen Oberfläche.
Silikate und Carbonate setzen sich ab, während Fluorit gesammelt und zu Trockenöfen gebracht wird..
Sobald der Fluorit erhalten ist, wird er mit Schwefelsäure umgesetzt, um Fluorwasserstoff zu erzeugen:
CaFzwei + H.zweiSW4 => 2 HF + CaSO4
Elektrolyse von Fluorwasserstoff
Bei der Herstellung von Fluor wird das von Moisson 1886 verwendete Verfahren mit einigen Modifikationen angewendet..
Eine Elektrolyse wird aus einer Mischung von geschmolzenem Kaliumfluorid und Flusssäure mit einem Molverhältnis von 1: 2,0 bis 1: 2,2 durchgeführt. Die Temperatur der Salzschmelze beträgt 70 - 130 ºC.
Die Kathode besteht aus einer Monel-Legierung oder einem Stahl, und die Anode besteht aus Degraphit-Kohlenstoff. Der Fluorproduktionsprozess während der Elektrolyse kann wie folgt beschrieben werden:
2HF => H.zwei + F.zwei
Zum Kühlen der Elektrolysekammer wird Wasser verwendet, die Temperatur muss jedoch über dem Schmelzpunkt des Elektrolyten liegen, um eine Verfestigung zu vermeiden. Bei der Elektrolyse erzeugter Wasserstoff wird an der Kathode und Fluor an der Anode gesammelt.
Isotope
Fluor hat 18 Isotope 19F das einzige stabile Isotop mit 100% iger Häufigkeit. Das 18F hat eine Halbwertszeit von 109,77 Minuten und ist das radioaktive Isotop von Fluor mit der längsten Halbwertszeit. Das 18F wird als Quelle für Positronen verwendet.
Biologische Rolle
Es ist keine metabolische Aktivität von Fluor bei Säugetieren oder höheren Pflanzen bekannt. Einige Pflanzen und Meeresschwämme synthetisieren jedoch Monofluoracetat, eine giftige Verbindung, die sie als Schutz verwenden, um ihre Zerstörung zu verhindern.
Risiken
Übermäßiger Konsum von Fluorid wurde mit Knochenfluorose bei Erwachsenen und Zahnfluorose bei Kindern sowie mit Veränderungen der Nierenfunktion in Verbindung gebracht. Aus diesem Grund schlug der United States Public Health Service (PHS) vor, dass die Fluoridkonzentration im Trinkwasser nicht höher als 0,7 mg / l sein sollte.
In der Zwischenzeit hat die US-Umweltschutzbehörde (EPA) festgelegt, dass die Fluoridkonzentration im Trinkwasser nicht höher als 4 mg / l sein sollte, um eine Skelettfluorose zu vermeiden, bei der sich Fluorid in den Knochen ansammelt. Dies kann zu einer Schwächung des Knochens und zu Knochenbrüchen führen..
Fluorid wurde mit einer Schädigung der Nebenschilddrüse in Verbindung gebracht, mit einer Abnahme des Kalziums in den Knochenstrukturen und hohen Konzentrationen von Kalzium im Plasma.
Zu den Veränderungen, die auf überschüssiges Fluorid zurückzuführen sind, gehören: Zahnfluorose, Skelettfluorose und Schädigung der Nebenschilddrüse.
Zahnfluorose
Zahnfluorose tritt mit kleinen Streifen oder Flecken im Zahnschmelz auf. Kinder unter 6 Jahren sollten keine fluoridhaltigen Mundwässer verwenden..
Skelettfluorose
Bei der Skelettfluorose können Schmerzen und Schäden an den Knochen sowie an den Gelenken diagnostiziert werden. Der Knochen kann hart werden und an Elastizität verlieren, was das Risiko von Frakturen erhöht.
Anwendungen
Zahnpasta

Wir beginnen mit dem Abschnitt über die Verwendung von Fluorid mit dem bekanntesten: dem, als Bestandteil vieler Zahnpasten zu dienen. Dies ist nicht die einzige Verwendung, bei der der Kontrast zwischen seinem F-Molekül geschätzt wirdzwei, extrem giftig und gefährlich, und das Anion F.-, was je nach Umgebung von Vorteil sein kann (wenn auch manchmal nicht).
Wenn wir Lebensmittel essen, insbesondere Süßigkeiten, bauen Bakterien diese ab, indem sie den Säuregehalt unseres Speichels erhöhen. Dann kommt ein Punkt, an dem der pH-Wert sauer genug ist, um den Zahnschmelz abzubauen und zu demineralisieren. Hydroxylapatit wird abgebaut.
Bei diesem Verfahren werden jedoch die Ionen F.- interagieren mit Ca.zwei+ eine Fluorapatitmatrix zu bilden; stabiler und haltbarer als Hydroxylapatit. Zumindest ist dies der vorgeschlagene Mechanismus, um die Wirkung des Fluoridanions auf die Zähne zu erklären. Es ist wahrscheinlich komplexer und weist ein pH-abhängiges Hydroxylapatit-Fluorapatit-Gleichgewicht auf.
Diese Anionen F.- Sie sind in Dentalpflanzen in Form von Salzen erhältlich; wie zum Beispiel: NaF, SnFzwei (das berühmte Zinnfluorid) und NaPOF. Die Konzentration von F.- Es muss niedrig sein (weniger als 0,2%), da es sonst negative Auswirkungen auf den Körper hat.
Wasserfluoridierung
Ähnlich wie Zahnpasta wurden den Trinkwasserquellen Fluoridsalze zugesetzt, um Hohlräume bei denjenigen zu bekämpfen, die sie trinken. Die Konzentration sollte noch viel niedriger sein (0,7 ppm). Diese Praxis ist jedoch häufig Gegenstand von Misstrauen und Kontroversen, da ihr mögliche krebserzeugende Wirkungen zugeschrieben wurden.
Oxidationsmittel
Gas F.zwei es verhält sich wie ein sehr starkes Oxidationsmittel. Dies führt dazu, dass viele Verbindungen schneller verbrennen als wenn sie Sauerstoff und einer Wärmequelle ausgesetzt werden. Deshalb wurde es in Raketentreibstoffgemischen eingesetzt, in denen es sogar Ozon ersetzen kann.
Polymere
In vielen Anwendungen sind die Beiträge von Fluor nicht auf das F zurückzuführenzwei oder F.-, aber direkt zu seinen elektronegativen Atomen als Teil einer organischen Verbindung. Im Wesentlichen sprechen wir von einer C-F-Verbindung..
Je nach Struktur sind Polymere oder Fasern mit CF-Bindungen normalerweise hydrophob, so dass sie nicht nass werden oder dem Angriff von Flusssäure widerstehen. Oder noch besser, sie können ausgezeichnete elektrische Isolatoren und nützliche Materialien sein, aus denen Gegenstände wie Rohre und Dichtungen hergestellt werden. Teflon und Nafion sind Beispiele für diese fluorierten Polymere.
Apotheker
Die Reaktivität von Fluor macht seine Verwendung für die Synthese mehrerer organischer oder anorganischer Fluorverbindungen fraglich. In organischen Stoffen, insbesondere solchen mit pharmakologischen Wirkungen, erhöht das Ersetzen eines ihrer Heteroatome durch F-Atome (positiv oder negativ) ihre Wirkung auf ihr biologisches Ziel..
Deshalb steht in der Pharmaindustrie die Modifikation einiger Medikamente durch Zugabe von Fluoratomen immer auf dem Tisch..
Sehr ähnlich ist bei Herbiziden und Fungiziden. Das Fluorid in ihnen kann ihre Wirkung und Wirksamkeit bei Insekten- und Pilzschädlingen erhöhen..
Glasgravur
Flusssäure wurde aufgrund ihrer Aggressivität gegenüber Glas und Keramik verwendet, um dünne und empfindliche Stücke dieser Materialien zu gravieren. normalerweise für die Herstellung von Mikrokomponenten von Computern oder für Glühbirnen bestimmt.
Urananreicherung
Eine der wichtigsten Anwendungen von elementarem Fluor ist die Anreicherung von Uran als 235U. Dazu werden Uranmineralien in Flusssäure gelöst, wodurch UF entsteht4. Dieses anorganische Fluorid reagiert dann mit dem F.zwei, um sich so in UF zu verwandeln6 ((235PUH6 Y. 238PUH6).
Anschließend und durch Gaszentrifugation wird die 235PUH6 trennt sich von 238PUH6 später oxidiert und als Kernbrennstoff gelagert werden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Krämer Katrina. (2019). Die Struktur von gefrorenem Fluor wurde nach 50 Jahren erneut überprüft. Die Royal Society of Chemistry. Wiederhergestellt von: chemistryworld.com
- Wikipedia. (2019). Fluor. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Fluor. PubChem-Datenbank. CID = 24524. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fakten zu Fluorelementen. Chemicool. Wiederhergestellt von: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21. Februar). Die überraschend häufigen Verwendungen des hochreaktiven Fluors. Wiederhergestellt von: sciencestruck.com
- Paola Opazo Sáez. (4. Februar 2019). Fluorid in Zahnpasta: Ist es gut oder schlecht für Ihre Gesundheit? Wiederhergestellt von: nacionfarma.com
- Karl Christe & Stefan Schneider. (08. Mai 2019). Fluor: chemisches Element. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Lenntech B.V. (2019). Periodensystem: Sauerstoff. Wiederhergestellt von: lenntech.com
- Gagnon Steve. (s.f.). Das Element Fluor. Jefferson Lab. Wiederhergestellt von: education.jlab.org
- Das medizinische und redaktionelle Inhaltsteam der American Cancer Society. (2015, 28. Juli). Wasserfluoridierung und Krebsrisiko. Wiederhergestellt von: cancer.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.