
Endotherme und exotherme Reaktion

EIN endotherme Reaktion benötigt Strom, während a exotherme Reaktion setzt Energie frei. Diese Klassifizierung chemischer Reaktionen berücksichtigt die Beteiligung von Energie entweder als Reaktant oder als Produkt..
Energie ist die Fähigkeit zu arbeiten oder Wärme zu erzeugen. Denken Sie daran, dass chemische Reaktionen eine Reorganisation von Atomen zwischen Substanzen mit Bruch oder Bildung chemischer Bindungen beinhalten. Im Allgemeinen geht diese Bildung oder das Aufbrechen chemischer Bindungen mit Änderungen der Energie des Systems einher..
| Endotherme Reaktion | Exotherme Reaktion | |
|---|---|---|
| Definition | Chemische Reaktion, bei der Energie absorbiert wird. | Chemische Reaktion, bei der Energie in Form von Wärme freigesetzt wird. |
| Ursprung der Energie | Der Umwelt | Vom System |
| Potenzielle Energie | Niedriger in Reaktanten als in Produkten. | Größer in Reaktanten als in Produkten. |
| Produktion | Nicht spontan | Spontan |
| Interne Energieänderung | ΔE> 0; interne Energieänderung größer als Null. | ΔE<0; cambio de energía interna menor que cero. |
| Temperatur | Nimmt ab | Steigt |
| Beispiele | Reaktionen in der Photosynthese und Synthese im Allgemeinen. | Ein brennendes Streichholz, Verbrennungsreaktionen. |
Was ist eine endotherme Reaktion??
Eine chemische Reaktion ist endotherm, wenn absorbiert Energie aus der Umwelt. In diesem Fall wird die Wärme von außen nach innen übertragen. Wenn wir ein Thermometer platzieren, während die endotherme Reaktion stattfindet, sinkt die Temperatur.
Das Wort "endotherm" stammt aus dem Griechischen endet am was bedeutet "innen" und Therme was "Wärme" bedeutet. Endotherme Reaktionen verlaufen nicht spontan.
Woher kommt die Energie bei endothermen Reaktionen??
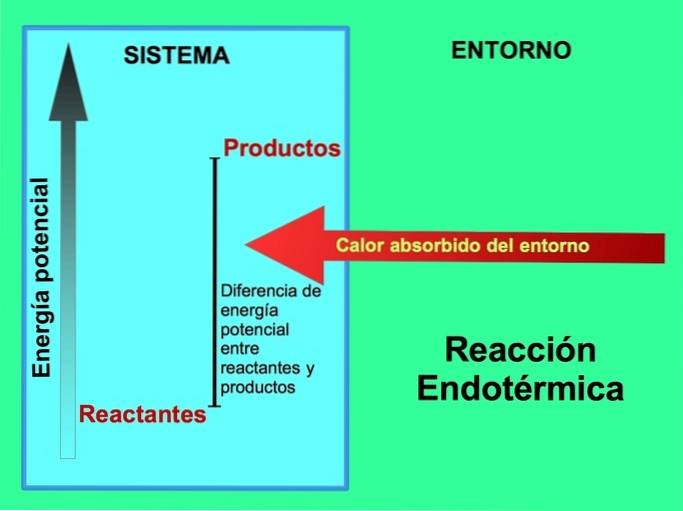
Bei endothermen Reaktionen kommt die Energie aus der Umgebung außerhalb des Systems. Die Menge an potentieller Energie der Produkte ist größer als die potentielle Energie der Reaktanten. Daher ist es erforderlich, den Reaktanten Energie zuzusetzen, damit die Reaktion abläuft. Diese Energie kommt aus der Wärme der Umwelt.
Beispielsweise, Die Photosynthese ist ein endothermer Prozess, wo Pflanzen Sonnenenergie gewinnen, um aus Kohlendioxid und Sauerstoff Glukose zu produzieren:

Die Produkte der Photosynthesereaktion, Glucose und Sauerstoff, haben eine größere Menge an potentieller Energie in Bezug auf die Reaktanten, Kohlendioxid und Wasser. Weitere Beispiele für endotherme chemische Reaktionen mit der verwendeten Energiemenge:

Beispiele für endotherme Reaktionen
Nicht nur im Chemielabor treten Reaktionen auf. Im Alltag finden wir auch Situationen, in denen endotherme Reaktionen auftreten.
Essen zubereiten
Obwohl es nicht so scheint, ist der Prozess des Kochens von Lebensmitteln endotherm. Um bestimmte Lebensmittel zu konsumieren, müssen wir Wärme bereitstellen.
Sofortiger Kühlbeutel
Kühlpackungen zur Behandlung von Unebenheiten oder Verstauchungen sind mit Wasser gefüllt. Beim Schütteln oder Klopfen bricht jedoch eine Kapsel mit Ammoniumnitrat im Inneren. Das Mischen von Ammoniumnitrat mit Wasser ist eine endotherme Reaktion, bei der der Beutel abkühlt.
Was ist eine exotherme Reaktion??
EIN Bei einer exothermen Reaktion fließt Energie aus dem System. Diese Energie wird in Form von Wärme freigesetzt, so dass das Einsetzen eines Thermometers in das Reaktionssystem die Temperatur erhöht.
Das Wort "exotherm" wird gebildet durch exo was bedeutet "nach außen" und thermes, was "Wärme" bedeutet. Exotherme Reaktionen können spontan auftreten und in einigen Fällen explosiv sein, beispielsweise die Kombination von Alkalimetallen und Wasser.
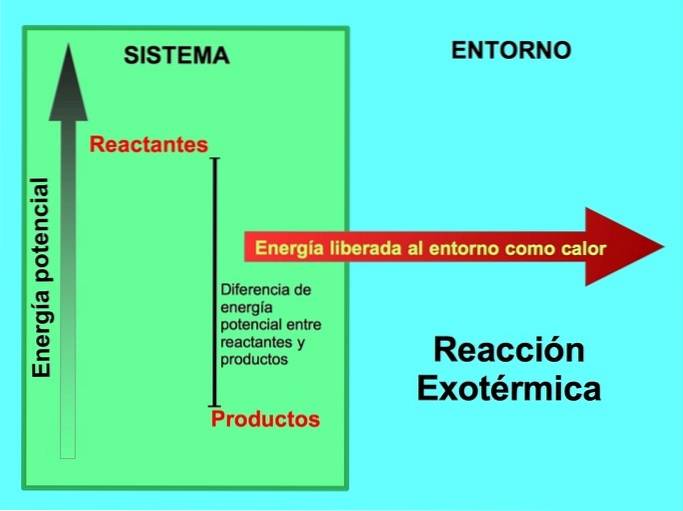
Woher kommt die Energie bei exothermen Reaktionen??
Bei einer chemischen Reaktion sind Reaktanten die Verbindungen, die Produkte umwandeln und entstehen lassen. Wenn beispielsweise Natrium-Na mit Chlor-Cl reagiert, sind dies die Reaktanten und das Produkt ist Natriumchlorid-NaCl:
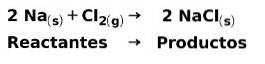
Sowohl Reaktanten als auch Produkte haben potentielle Energie gespeichert. Wir wissen aus dem lEnergieeinsparung ey Diese Energie geht weder verloren noch wird sie gewonnen, daher muss die Energie der Reaktanten gleich der der Produkte sein.
Bei einer exothermen Reaktion wird lReaktanten haben im Vergleich zu Produkten mehr potentielle Energie, so wird die überschüssige Energie als Wärme freigesetzt. In diesem Fall wird Energie auch als Teil der Produkte betrachtet:

Bei jedem exothermen Prozess wird ein Teil der in chemischen Bindungen gespeicherten potentiellen Energie durch Wärme in Wärmeenergie umgewandelt..
Beispiele für exotherme Reaktionen
Waschmittel
Wenn wir ein wenig Waschpulver mit Wasser in unseren Händen auflösen, spüren wir eine leichte Erwärmung.
Hausgasverbrennung
Die Verbrennung von Gasen für den Hausgebrauch wie Methan oder Butan beinhaltet die chemische Reaktion mit Sauerstoff unter Bildung von Kohlendioxid und Wasser und die Freisetzung von Energie. Dies ist eine typische exotherme Reaktion im täglichen Gebrauch:
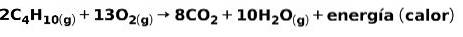
Die beim Verbrennungsprozess freigesetzte Energie wird zum Kochen von Speisen verwendet.
Möglicherweise möchten Sie auch wissen, was offenes System, geschlossenes System und isoliertes System sind.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.