
Was sind die Van-der-Waals-Kräfte?
Das Van der Waals Kräfte Sie sind intermolekulare Kräfte elektrischer Natur, die attraktiv oder abstoßend sein können. Es gibt eine Wechselwirkung zwischen den Oberflächen der Moleküle oder Atome, die sich im Wesentlichen von den ionischen, kovalenten und metallischen Bindungen unterscheidet, die innerhalb der Moleküle gebildet werden..
Obwohl diese Kräfte schwach sind, können sie Gasmoleküle anziehen. auch die von verflüssigten und erstarrten Gasen und die aller organischen Flüssigkeiten und Feststoffe. Johannes Van der Waals (1873) war derjenige, der eine Theorie entwickelte, um das Verhalten realer Gase zu erklären.

In der sogenannten Van-der-Waals-Gleichung für reale Gase - (P. + zunzwei/ V.zwei) (V - nb)) = nRT - zwei Konstanten werden eingeführt: die Konstante b (dh das von den Gasmolekülen eingenommene Volumen) und "a", eine empirische Konstante.
Die Konstante "a" korrigiert die Abweichung vom erwarteten Verhalten idealer Gase bei niedrigen Temperaturen, genau dort, wo die Anziehungskraft zwischen den Gasmolekülen ausgedrückt wird. Die Fähigkeit eines Atoms, im Periodensystem zu polarisieren, nimmt von oben nach unten und über einen Zeitraum von rechts nach links zu..
Durch Erhöhen der Ordnungszahl - und damit der Anzahl der Elektronen - können diejenigen, die sich in den Außenschalen befinden, leichter bewegt werden, um polare Elemente zu bilden.
Artikelverzeichnis
- 1 Intermolekulare elektrische Wechselwirkungen
- 1.1 Wechselwirkung zwischen permanenten Dipolen
- 1.2 Wechselwirkung zwischen einem permanenten Dipol und einem induzierten Dipol
- 2 Londoner Streitkräfte oder Zerstreuung
- 3 Van der Waals-Radios
- 4 Kräfte und Energie der elektrischen Wechselwirkung zwischen Atomen und Molekülen
- 5 Referenzen
Intermolekulare elektrische Wechselwirkungen
Wechselwirkung zwischen permanenten Dipolen
Es gibt elektrisch neutrale Moleküle, die permanente Dipole sind. Dies ist auf eine Störung in der elektronischen Verteilung zurückzuführen, die eine räumliche Trennung der positiven und negativen Ladungen zu den Enden des Moleküls bewirkt und einen Dipol bildet (als wäre es ein Magnet)..
Wasser besteht aus 2 Wasserstoffatomen an einem Ende des Moleküls und einem Sauerstoffatom am anderen Ende. Sauerstoff hat eine höhere Affinität zu Elektronen als Wasserstoff und zieht sie an.
Dies erzeugt eine Verschiebung von Elektronen in Richtung Sauerstoff, wobei dieser negativ geladen und Wasserstoff mit einer positiven Ladung belassen wird..

Die negative Ladung eines Wassermoleküls kann elektrostatisch mit der positiven Ladung eines anderen Wassermoleküls interagieren und eine elektrische Anziehung verursachen. Daher wird diese Art der elektrostatischen Wechselwirkung als Keesom-Kräfte bezeichnet.
Wechselwirkung zwischen einem permanenten Dipol und einem induzierten Dipol
Der permanente Dipol hat ein sogenanntes Dipolmoment (µ). Die Größe des Dipolmoments ergibt sich aus dem mathematischen Ausdruck:
µ = q.x.
q = elektrische Ladung.
x = räumlicher Abstand zwischen den Polen.
Das Dipolmoment ist ein Vektor, der konventionell vom negativen zum positiven Pol ausgerichtet dargestellt wird. Die Größe von µ tut weh, um sich in Debye auszudrücken (3,34 × 10-30 Cm.
Der permanente Dipol kann mit einem neutralen Molekül interagieren und eine Änderung seiner elektronischen Verteilung verursachen, was zu einem induzierten Dipol in diesem Molekül führt.
Der permanente Dipol und der induzierte Dipol können elektrisch interagieren und eine elektrische Kraft erzeugen. Diese Art der Wechselwirkung wird als Induktion bezeichnet und die darauf einwirkenden Kräfte werden als Debye-Kräfte bezeichnet..
Londoner Streitkräfte oder Zerstreuung
Die Natur dieser Anziehungskräfte wird durch die Quantenmechanik erklärt. London postulierte, dass in elektrisch neutralen Molekülen das Zentrum der negativen Ladungen der Elektronen und das Zentrum der positiven Ladungen der Kerne augenblicklich nicht zusammenfallen könnten..
Die Fluktuation der Elektronendichte ermöglicht es den Molekülen, sich als temporäre Dipole zu verhalten.
Dies ist an sich keine Erklärung für Anziehungskräfte, aber temporäre Dipole können eine richtig ausgerichtete Polarisation benachbarter Moleküle induzieren, was zur Erzeugung einer Anziehungskraft führt. Die durch elektronische Schwankungen erzeugten Anziehungskräfte werden als Londoner Kräfte oder Dispersion bezeichnet..
Van-der-Waals-Kräfte zeigen Anisotropie, weshalb sie von der Orientierung der Moleküle beeinflusst werden. Wechselwirkungen vom Dispersionstyp sind jedoch immer überwiegend attraktiv..
Die Londoner Kräfte werden stärker, wenn die Größe der Moleküle oder Atome zunimmt.
In Halogenen sind die F-Molekülezwei und Clzwei niedrige Ordnungszahlen sind Gase. Der BRzwei mit der höchsten Ordnungszahl ist eine Flüssigkeit und das I.zwei, Das Halogen mit der höchsten Ordnungszahl ist bei Raumtemperatur ein Feststoff.
Durch Erhöhen der Ordnungszahl wird die Anzahl der vorhandenen Elektronen erhöht, was die Polarisation der Atome und damit die Wechselwirkungen zwischen ihnen erleichtert. Dies bestimmt den physikalischen Zustand der Halogene.
Van der Waals Radios
Die Wechselwirkungen zwischen Molekülen und zwischen Atomen können abhängig von einem kritischen Abstand zwischen ihren Zentren, der als r bezeichnet wird, attraktiv oder abstoßend seinv.
Bei Abständen zwischen Molekülen oder Atomen größer als rv, Die Anziehungskraft zwischen den Kernen eines Moleküls und den Elektronen des anderen Moleküls überwiegt gegenüber den Abstoßungen zwischen den Kernen und den Elektronen der beiden Moleküle.
Im beschriebenen Fall ist die Wechselwirkung attraktiv, aber was passiert, wenn sich die Moleküle in einem Abstand zwischen ihren Zentren nähern, der kleiner als rv ist? Dann überwiegt die Abstoßungskraft gegenüber der Anziehungskraft, die einer engeren Annäherung zwischen den Atomen entgegenwirkt..
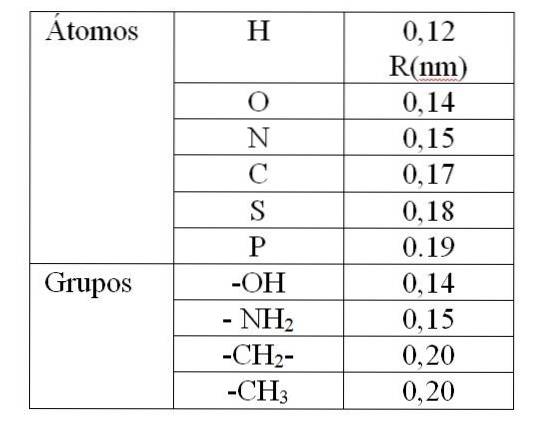
Der Wert von rv Es wird durch die sogenannten Van-der-Waals-Radien (R) gegeben. Für kugelförmige und identische Moleküle rv gleich 2R. Für zwei verschiedene Radienmoleküle R.1 und R.zwei: rv gleich R.1 + R.zwei. Die Werte der Van-der-Waals-Radien sind in Tabelle 1 angegeben.
Der in Tabelle 1 angegebene Wert gibt einen Van-der-Waals-Radius von 0,12 nm an (10-9 m) für Wasserstoff. Dann ist der Wert von rv für dieses Atom ist es 0,24 nm. Für einen Wert von rv weniger als 0,24 nm erzeugen eine Abstoßung zwischen den Wasserstoffatomen.
Kräfte und Energie der elektrischen Wechselwirkung zwischen Atomen und Molekülen
Die Kraft zwischen einem Ladungspaar q1 und waszwei, im Vakuum durch den Abstand r getrennt, ist durch das Coulombsche Gesetz gegeben.
F = k. Was1.Waszwei/ rzwei
In diesem Ausdruck ist k eine Konstante, deren Wert von den verwendeten Einheiten abhängt. Wenn der Wert der Kraft - gegeben durch die Anwendung des Coulombschen Gesetzes - negativ ist, zeigt dies eine Anziehungskraft an. Im Gegenteil, wenn der für die Kraft angegebene Wert positiv ist, zeigt dies eine abstoßende Kraft an.
Da sich die Moleküle normalerweise in einem wässrigen Medium befinden, das die ausgeübten elektrischen Kräfte abschirmt, muss der Begriff Dielektrizitätskonstante (ε) eingeführt werden. Somit korrigiert diese Konstante den Wert, der für die elektrischen Kräfte durch Anwendung des Coulombschen Gesetzes gegeben ist.
F = k.q.1.Waszwei/ε.rzwei
In ähnlicher Weise ist die Energie für die elektrische Wechselwirkung (U) durch den Ausdruck gegeben:
U = k. Was1.Waszwei/ε.r
Verweise
- Die Herausgeber der Encyclopaedia Britannica. (2018). Van der Waals Kräfte. Abgerufen am 27. Mai 2018 von: britannica.com
- Wikipedia. (2017). Van der Waals Kräfte. Abgerufen am 27. Mai 2018 von: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth und Irene Ly. Van der Waals Kräfte. Abgerufen am 27. Mai 2018 von: chem.libretexts.org
- Morris, J. G. (1974) Physikalische Chemie eines Biologen. 2und Ausgabe. Edward Arnold (Verlag) Limited.
- Mathews, C.K., Van Holde, K.E. und Ahern, K.G. (2002) Biochemistry. Dritte Edition. Addison Wesley Longman, Inc..



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.