
Was ist eine verdünnte Lösung? Faktoren und Beispiele
EIN verdünnte Lösung oder ungesättigtEs ist eine chemische Lösung, die die maximale Konzentration des in einem Lösungsmittel gelösten gelösten Stoffes nicht erreicht hat. Der zusätzliche gelöste Stoff löst sich auf, wenn er zu einer verdünnten Lösung gegeben wird, und erscheint nicht in der wässrigen Phase..
Aus physikalisch-chemischer Sicht wird eine ungesättigte Lösung als dynamischer Gleichgewichtszustand angesehen, bei dem die Geschwindigkeit, mit der das Lösungsmittel den gelösten Stoff löst, größer ist als die Geschwindigkeit der Rekristallisation..
Ein Beispiel für eine verdünnte Lösung ist in Abbildung 1 dargestellt. In den Abbildungen 1.1, 1.2 und 1.3 befindet sich ein konstantes Wasservolumen im Becher.
In Abbildung 1.1 beginnt der Prozess dort, wo sich der gelöste Stoff aufzulösen beginnt, dargestellt durch die roten Pfeile. In diesem Fall sind zwei Phasen zu sehen, eine flüssige und eine feste.
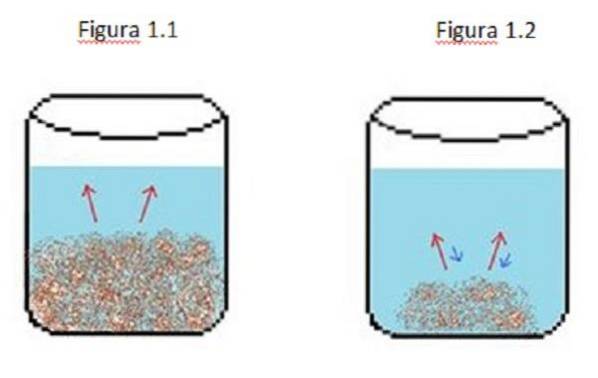
In Abbildung 1.2 hat sich ein Großteil des Feststoffs aufgelöst, jedoch nicht vollständig aufgrund des Rekristallisationsprozesses, der durch die blauen Pfeile dargestellt wird..
In diesem Fall sind die roten Pfeile größer als die blauen Pfeile, was bedeutet, dass die Verdünnungsrate größer als die Rekristallisationsrate ist. Zu diesem Zeitpunkt haben Sie eine ungesättigte Lösung.
Wir können also sagen, dass eine verdünnte Lösung mehr gelösten Stoff darin lösen kann, bis sie den Sättigungspunkt erreicht. Am Sättigungspunkt löst sich kein gelöster Stoff mehr im Lösungsmittel und eine solche Lösung wird als gesättigte Lösung bezeichnet..
Auf diese Weise sind die Lösungen zunächst ungesättigter Natur und werden schließlich durch Zugabe von gelöstem Stoff zu gesättigten Lösungen..
Was ist eine verdünnte Lösung??
Eine verdünnte Lösung ist die ungesättigte, gesättigte oder übersättigte Lösung, der mehr Lösungsmittel zugesetzt wird. Das Ergebnis ist eine ungesättigte Lösung mit geringerer Konzentration.
Verdünnungen sind ein üblicher Prozess in einem chemischen Labor. Im Allgemeinen arbeiten Sie mit verdünnten Lösungen, die aus Stammlösungen hergestellt werden, die direkt von einem bestimmten Händler gekauft wurden.
Zur Herstellung der Verdünnungen wird die Formel C verwendet1V.1= C.zweiV.zwei wobei C die Konzentration der Lösung ist, im Allgemeinen in Bezug auf Molarität oder Normalität. V ist das Volumen der Lösung in ml und die Terme 1 und 2 entsprechen den konzentrierten bzw. verdünnten Lösungen.
Faktoren, die die Löslichkeit beeinflussen
Die Menge an gelöstem Stoff, die in einem Lösungsmittel gelöst werden kann, hängt von verschiedenen Faktoren ab, darunter die wichtigsten:
1- Temperatur
Die Löslichkeit nimmt mit der Temperatur zu. Beispielsweise kann in heißem Wasser mehr Salz gelöst werden als in kaltem Wasser..
Es kann jedoch Ausnahmen geben, zum Beispiel nimmt die Löslichkeit von Gasen in Wasser mit zunehmender Temperatur ab..
In diesem Fall erhalten die gelösten Moleküle beim Erhitzen kinetische Energie, was ihr Entweichen erleichtert..
2- Druck
Erhöhter Druck kann die Auflösung gelöster Stoffe erzwingen. Dies wird üblicherweise verwendet, um Gase in Flüssigkeiten zu lösen..
3- Chemische Zusammensetzung
Die Art des gelösten Stoffes und des Lösungsmittels sowie das Vorhandensein anderer chemischer Verbindungen in der Lösung beeinflussen die Löslichkeit..
Zum Beispiel kann mehr Zucker in Wasser gelöst werden als Salz in Wasser. In diesem Fall wird gesagt, dass Zucker löslicher ist.
Ethanol und Wasser sind vollständig miteinander löslich. In diesem speziellen Fall ist das Lösungsmittel die Verbindung, die in der größten Menge gefunden wird.
4- Mechanische Faktoren
Im Gegensatz zu der Auflösungsrate, die hauptsächlich von der Temperatur abhängt, hängt die Rekristallisationsrate von der Konzentration des gelösten Stoffes auf der Oberfläche des Kristallgitters ab, die bevorzugt wird, wenn eine Lösung unbeweglich ist.
Daher verhindert das Rühren der Lösung diese Akkumulation, wodurch die Auflösung maximiert wird..
Sättigungs- und Löslichkeitskurven
Die Löslichkeitskurven sind eine grafische Datenbank, in der die Menge an gelöstem Stoff, die sich in einer Menge an Lösungsmittel löst, bei einer bestimmten Temperatur verglichen wird.
Löslichkeitskurven werden üblicherweise für eine Menge gelösten Stoffes, entweder fest oder gasförmig, in 100 g Wasser aufgezeichnet. Die Sättigungskurven für verschiedene gelöste Stoffe in Wasser sind in Abbildung 2 dargestellt..
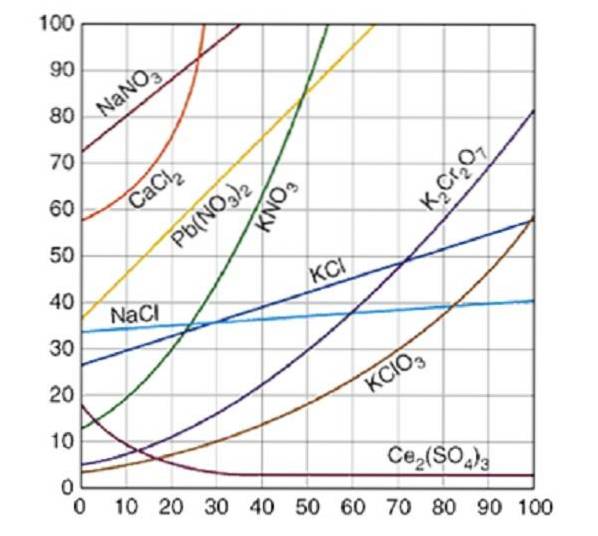
Die Kurve gibt den Sättigungspunkt bei einer bestimmten Temperatur an. Der Bereich unter der Kurve zeigt an, dass Sie eine ungesättigte Lösung haben und daher mehr gelöster Stoff hinzugefügt werden kann. Im Bereich oberhalb der Kurve befindet sich eine übersättigte Lösung.
Am Beispiel von Natriumchlorid (NaCl) können bei 25 Grad Celsius ungefähr 35 Gramm NaCl in 100 Gramm Wasser gelöst werden, um eine gesättigte Lösung zu erhalten.
Beispiele für verdünnte Lösungen
Ungesättigte Lösungen können täglich gefunden werden, es ist nicht notwendig, in einem chemischen Labor zu sein.
Das Lösungsmittel muss nicht unbedingt Wasser sein. Nachfolgend finden Sie Beispiele für verdünnte Lösungen:
- Wenn Sie einer Tasse heißen Kaffees einen Esslöffel Zucker hinzufügen, entsteht eine ungesättigte Zuckerlösung.
- Essig ist eine verdünnte Lösung von Essigsäure in Wasser.
- Nebel ist eine ungesättigte (aber nahezu gesättigte) Lösung von Wasserdampf in der Luft.
- 0,01 M HCl ist eine ungesättigte Salzsäurelösung in Wasser.
- Reinigungsalkohol ist eine verdünnte Lösung von Isopropylalkohol in Wasser.
- Die Suppe ist eine ungesättigte Lösung aus Wasser und Natriumchlorid.
- Alkoholische Getränke sind verdünnte Lösungen von Ethanol und Wasser. Normalerweise wird der Prozentsatz an Alkohol angezeigt, den sie haben.
Verweise
- Anne Marie Helmenstine, P. (2016, 7. Juli). Definition und Beispiele für gesättigte Lösungen. Von about.com wiederhergestellt.
- Cambrige Universität. (s.f.). Löslichkeitskurven. Von dynamiccience.com.au wiederhergestellt.
- Beispiele für gesättigte Lösung. (s.f.). Wiederhergestellt von examples.yourdcitionary.com.
- J., S. (2014, 4. Juni). Gesättigte und übersättigte Lösungen. Von socratic.org wiederhergestellt.
- James, N. (s.f.). Gesättigte Lösung: Definition & Beispiele. Von study.com wiederhergestellt.
- M., B. (2014, 14. Oktober). Gesättigte und übersättigte Lösungen. Von socratic.org wiederhergestellt.
- Löslichkeitskurven. (s.f.). Von kentchemistry.com wiederhergestellt.
- Tipps der Sättigung. (2014, 26. Juni). Von chem.libretexts.org wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.