
Nickel (III) -hydroxidstruktur, Eigenschaften, Verwendungen, Risiken

Das Nickel (III) -hydroxid Es ist eine anorganische Verbindung, bei der Nickelmetall eine Oxidationszahl von 3+ aufweist. Seine chemische Formel lautet Ni (OH)3. Den konsultierten Quellen zufolge war es bisher nicht möglich, das Vorhandensein von Nickel (III) -hydroxid Ni (OH) nachzuweisen.3, es war jedoch möglich, Nickel (III) -oxohydroxid, NiO (OH) zu erhalten..
Nickel (III) -oxohydroxid NiO (OH) ist ein schwarzer kristalliner Feststoff, der in zwei Formen kristallisiert: der Beta-Form und der Gamma-Form. Die häufigste kristalline Form von NiO (OH) ist Beta.
NiO (OH) kann durch Oxidation von Nickel (II) -nitratlösungen (Ni (NO) erhalten werden3)zwei) mit Chlor (Clzwei) oder Brom (Brzwei) in Gegenwart von Kaliumhydroxid (KOH). Nickel (III) oxohydroxid ist in Säuren sehr gut löslich. Es findet Anwendung in Nickelbatterien, in Superkondensatoren und als regenerierbarer Katalysator.
Nickel (III) oxohydroxid NiO (OH) und Nickel (II) hydroxid Ni (OH)zwei sind im Betrieb der meisten ihrer Anwendungen vereint, da beide Teil derselben Oxidreduktionsgleichung sind.
Als Nickelverbindung birgt NiO (OH) die gleichen Risiken wie andere Nickelsalze, dh Hautreizungen oder Dermatitis und Krebs.
Artikelverzeichnis
- 1 Kristallstruktur
- 2 Elektronische Konfiguration
- 3 Nomenklatur
- 4 Eigenschaften
- 4.1 Physikalischer Zustand
- 4.2 Löslichkeit
- 4.3 Andere Eigenschaften
- 5 Verwendungen
- 5.1 In Nickelbatterien
- 5.2 Bei der Elektrokatalyse als regenerierbarer Katalysator
- 5.3 In Superkondensatoren
- 5.4 Bei der Oxidation von Metallionen
- 6 Risiken
- 7 Referenzen
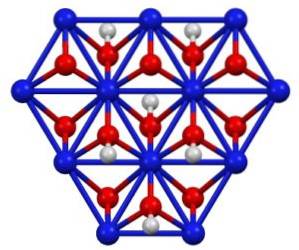
Kristallstruktur
Nickel (III) -oxohydroxid kristallisiert in zwei Formen: Beta und Gamma. Die Beta-Form β-NiO (OH) hat eine sehr ähnliche Struktur wie β-Ni (OH)zwei, was logisch erscheint, da das erstere aus der Oxidation des letzteren stammt.
Die Gamma-γ-NiO (OH) -Form ist das Oxidationsprodukt von Nickel (II) -hydroxid in seiner Alpha-Form, α-Ni (OH)zwei. Wie letzteres hat Gamma eine Schichtstruktur mit Alkalimetallionen, Anionen und Wasser, die zwischen den Schichten verteilt sind..
Elektronische Konfiguration
In NiO (OH) befindet sich Nickel in der Oxidationsstufe 3+, was bedeutet, dass in seinen äußersten Schichten 3 Elektronen fehlen, dh zwei Elektronen fehlen in Schicht 4s und ein Elektron aus Schale 3d. Die Elektronenkonfiguration von Ni3+ in NiO (OH) ist es: [Ar] 3d7, wobei [Ar] die Elektronenkonfiguration des Edelgases Argon ist.
Nomenklatur
- NiO (OH): Nickel (III) -oxohydroxid
- Nickel schwarz
Eigenschaften
Körperlicher Status
Schwarzer kristalliner Feststoff.
Löslichkeit
NiO (OH) -Oxohydroxid ist in Säuren sehr gut löslich. Die Gammaphase löst sich unter Sauerstoffentwicklung in Schwefelsäure.
Andere Eigenschaften
In heißem Wasser wird es zu Nickel (II) und (III) Oxohydroxid, Ni3ODERzwei(OH)4.
Es zersetzt sich bei 140 ºC in Nickel (II) oxid (NiO), Wasser und Sauerstoff.
Die Gammaphase (γ-NiO (OH)) kann auf verschiedene Weise erhalten werden, beispielsweise durch Behandeln von Nickel mit einer geschmolzenen Mischung von Natriumperoxid (Na)zweiODERzwei) und Natriumhydroxid (NaOH) bei 600 ºC und Abkühlen in Eiswasser.
Die Gammaphase zersetzt sich beim Erhitzen auf 138 ºC.
Anwendungen
In Nickelbatterien
Edisons Nickel-Eisen-Batterie, in der KOH als Elektrolyt verwendet wird, basiert auf der Reaktion von Nickel (III) -oxohydroxid mit Eisen:
Herunterladen:
Fe + 2NiO (OH) + H.zweiO ⇔ Fe (OH)zwei + 2Ni (OH)zwei
Belastung:
Es ist eine reversible Oxidations-Reduktions-Reaktion.
An der Anode dieser Batterien finden eine Reihe chemischer und elektrochemischer Prozesse statt. Hier ist ein allgemeiner Überblick:
Herunterladen
β-Ni (OH)zwei ⇔ β-NiO (OH) + H.+ + und-
Belastung
Altern ↑ ↓ Überlastung
Herunterladen
α-Ni (OH)zwei ⇔ γ-NiO (OH) + H.+ + und-
Belastung
In der Nickelbatterietechnologie wird Nickel (III) -oxohydroxid NiO (OH) als "aktive Nickelmasse" bezeichnet..

Bei der Elektrokatalyse als regenerierbarer Katalysator
NiO (OH) wurde erfolgreich bei der Elektrosynthese von Azopyrazolen durch elektrokatalytische Oxidation von Aminopyrazolen eingesetzt. Seine Nützlichkeit bei der Synthese von Carbonsäuren ausgehend von Alkoholen oder Carbonylverbindungen wurde ebenfalls nachgewiesen..

Ein weiteres Beispiel ist die quantitative Umwandlung von Hydroxymethylpyridin zu einer Pyridincarbonsäure. In diesem Fall ist die der Anode entsprechende Stahl- oder Nickelelektrode mit einer Schicht aus NiO (OH) bedeckt. Das Medium, in dem die Elektrolyse durchgeführt wird, ist alkalisch.
Bei diesen Reaktionen wirkt NiO (OH) als Reduktions-Oxidations-Mediator oder "Redox" -Mediator..
Die Elektrolyse wird in einer Zelle mit Nickelanode und Titankathode in einem alkalischen Medium durchgeführt. Während des Prozesses entsteht Ni (OH)zwei auf der Oberfläche der Nickelanode, die schnell zu NiO (OH) oxidiert wird:
Ni (OH)zwei + Oh- - und- ⇔ NiO (OH) + H.zweiODER
Das NiO (OH) reagiert mit dem organischen Substrat und das gewünschte organische Produkt wird erhalten, wobei das Ni (OH) regeneriert wird.zwei::
NiO (OH) + organische Verbindung → Ni (OH)zwei + Produkt
B. Ni (OH) regeneriertzwei, Die Katalyse-Reaktion wird fortgesetzt.
Die Verwendung von NiO (OH) als Elektrokatalysator ermöglicht die kostengünstige und umweltfreundliche Gewinnung organischer Verbindungen.
In Superkondensatoren
NiO (OH) zusammen mit Ni (OH)zwei eignen sich hervorragend für Superkondensatorelektroden. Superkondensatoren).
Ni (OH)zwei + Oh- ⇔ NiO (OH) + H.zweiO + e-
Sie haben eine hohe Kapazität, niedrige Kosten und nach einigen Referenzen eine geringe Umweltbelastung.

Sie haben jedoch eine geringe Leitfähigkeit. Dies wird durch Verwendung von Nanopartikeln dieser Verbindungen gelöst, da dies die Oberfläche vergrößert und den für die Diffusion erforderlichen Abstand verringert, was eine hohe Übertragungsgeschwindigkeit von Elektronen und / oder Ionen gewährleistet..
Bei der Oxidation von Metallionen
Eine der kommerziellen Anwendungen von Nickel (III) -oxohydroxid basiert auf seiner Fähigkeit, Cobalt (II) -Ionen in Lösung zu Cobalt (III) -Ionen zu oxidieren..
Risiken
Nickel in Lösung ist stabiler als Ni-Ionenzwei+, Daher ist es nicht üblich, mit Ni-Lösungen in Kontakt zu kommen3+. Die Vorsichtsmaßnahmen sind jedoch dieselben, da Nickel, ob metallisch, in Lösung oder in Form seiner festen Salze, eine Hautsensibilisierung verursachen kann..
Es wird empfohlen, Schutzausrüstung und Kleidung wie einen Gesichtsschutz, Handschuhe und Sicherheitsschuhe zu verwenden. All dies muss immer dann verwendet werden, wenn die Möglichkeit besteht, mit Nickellösungen in Kontakt zu kommen..
Wenn eine Dermatitis auftritt, sollte diese mit einem Arzt behandelt werden, um auszuschließen, dass sie durch Nickel verursacht wird..
In Bezug auf die Möglichkeit des Einatmens ist es empfehlenswert, die Konzentrationen von Nickelsalzstaub in der Luft durch lokale Belüftung sehr niedrig zu halten und bei Bedarf Atemschutz zu verwenden..
Alle Nickelverbindungen sind von der Internationalen Agentur für Krebsforschung (IARC) klassifiziert. Internationale Agentur für Krebsforschung) in der Kategorie der Karzinogene für den Menschen.
Dies basiert auf epidemiologischen und experimentellen Daten.
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Lyalin, B.V. et al. Elektrosynthese von Azopyrazolen durch Oxidation von N-Alkylaminopyrazolen an einer NiO (OH) -Anode in wässrigem Alkali - Eine grüne Methode zur N-N-Homokupplung. Tetraeder-Buchstaben. 59 (2018) 2741-2744. Von sciencedirect.com wiederhergestellt.
- Liuyang, Zhang et al. (2018). Materialien auf Nickelbasis für Superkondensatoren. Materialien heute. Von sciencedirect.com wiederhergestellt
- Ettel, V.A. und Mosolu, M. A. (1977). Herstellung von Nickelschwarz. UNS. Patent Nr. 4,006,216. 1. Februar 1977.
- Scharbert, B. (1993). Verfahren zur Oxidation von Hydroxymethylpyridinderivaten zu Pyridincarbonsäurederivaten an Nickeloxidhydroxidanoden. UNS. Patent Nr. 5,259,933. 9. November 1993.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 17. Vierte Ausgabe. John Wiley & Sons.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. Band A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Nickelhydroxide. Im Handbuch der Batteriematerialien. VCH Verlag. Von osti.gov wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.