
Was ist Karyolyse?
Das Karyolyse ist eine der Veränderungen, die in den Zellkernen festgestellt werden, wenn sie infolge von Noxa oder äußeren Schäden absterben, z. B. aufgrund von Hypoxie (unzureichende Sauerstoffversorgung) oder toxischen Substanzen.
Sein Name leitet sich vom griechischen Karyon ab, was "Kern" und Lyse bedeutet, was als "Abschwächung" oder Auflösung "interpretiert werden kann; daher bedeutet der Begriff Karyolyse wörtlich "Auslöschung des Kerns".
Dieses Phänomen tritt während des Nekrofanerose-Stadiums wie Pyknose und Karyorrhexis auf und kann die einzige nukleare Veränderung sein oder in ein Kontinuum aufgenommen werden, das mit Pyknose beginnt, Karyorrhexis durchläuft und in Karyolyse endet..
Wie bei der Karyorrhexis geht die nukleare Veränderung den zytoplasmatischen Veränderungen voraus, und der gesamte Prozess geht mit einer Entzündung der extrazellulären Matrix einher, was für die Nekrose charakteristisch ist und als grundlegender Unterschied zur Apoptose angesehen werden kann, bei der es kein entzündliches Komplement gibt.
Karyolyse tritt aufgrund der Wirkung von Kernenzymen auf, die unter normalen Bedingungen dazu beitragen, DNA abzuwickeln und zu fragmentieren, so dass sie transkribiert werden kann, aber unter Bedingungen des Zelltods aufgrund von Noxa (Nekrose) beginnen, den Kern in seiner Gesamtheit zu zersetzen.
Artikelverzeichnis
- 1 Kernenzyme
- 1.1 Klassifizierung von Kernenzymen
- 2 Arten von Nukleasen
- 2.1 Endonukleasen
- 2.2 Restriktionsendonukleasen
- 2.3 Exonukleasen
- 3 Pathophysiologie der Karyolyse
- 4 Befunde bei der Lichtmikroskopie
- 5 Referenzen
Kernenzyme
Die Enzyme des Zellkerns sind vielfältig und sehr spezifisch und für die Physiologie von DNA und RNA von entscheidender Bedeutung.
Da die Gene und Chromosomen unter Bildung von Chromatin strukturiert sind, ist eine DNA-Transkription und -Replikation praktisch unmöglich, da es sich um eine kontinuierliche Kette handelt, die extrem lang ist und eine sehr komplexe dreidimensionale räumliche Konformation aufweist..
Um den Replikations- und Transkriptionsprozess zu erleichtern, "schneiden" Kernenzyme das zu transkribierende DNA-Fragment, wodurch die RNA an eine lineare Kette von Desoxyribonukleinsäure mit einem sehr klaren Anfang und Ende gekoppelt werden kann..
Kernenzyme, auch als „Phosphodiesterasen“ bekannt, können Phosphodiesterbindungen spalten, Schlüsselelemente in der Struktur von Nukleinsäuren, und auch die intrazellulären Spiegel von cyclischem AMP und GMP regulieren.
Klassifikation von Kernenzymen
Abhängig von der Stelle, an der Endonukleasen ihre Wirkung entfalten, werden sie in zwei große Kategorien eingeteilt: Nukleasen und Ligasen..
Bisher wurden die Wirkungen von Nukleaseenzymen, die für das "Schneiden" von DNA-Stücken verantwortlich sind, um deren Replikation zu ermöglichen, grob beschrieben. Sobald die Transkription eines DNA-Fragments abgeschlossen ist, muss es jedoch wieder in den großen Strang integriert werden von Desoxyribonukleinsäure, zu der es gehört, und auch in einer bestimmten Position zu tun.
Hier kommen die "Ligasen" ins Spiel, Enzyme, die in der Lage sind, an ihrer Stelle eine DNA-Kette zu "kleben", die zuvor durch Phosphodiesterasen gespalten wurde..
Das empfindliche Gleichgewicht zwischen Nukleasen und Ligasen ermöglicht die Aufrechterhaltung der Integrität des genetischen Materials, so dass Probleme vorhergesagt werden können, wenn die Aktivität eines Enzyms das andere übersteigt.
Arten von Nukleasen
Um die Rolle der Phosphodiesterase bei der Karyolyse zu verstehen, ist es wichtig, die verschiedenen existierenden Typen zu kennen, da sie für den gesamten Prozess verantwortlich sind.
In diesem Sinne spielen die Ligasen praktisch keine Rolle, tatsächlich wird ihre Aktivität aufgehoben, was es unmöglich macht, den durch die Nukleasen initiierten Prozess umzukehren..
Entsprechend der Stelle, an der sie ihre Wirkung ausüben, werden Nukleasen unterteilt in:
- Endonukleasen
- Exonukleasen
- Restriktionsendonukleasen
Zusätzlich zu den Enzymen, die DNA spalten können (auch als DNasen bekannt), gibt es im Kern auch Enzyme mit der Fähigkeit, RNA-Segmente zu "schneiden" und zu modellieren, wobei diese als Ribonukleasen oder RNasen bekannt sind..
Obwohl diese Enzyme für die normale Physiologie der Zelle wichtig sind, spielen sie während des Nekroseprozesses eine untergeordnete Rolle..
Endonukleasen
Endonukleasen sind Enzyme, die DNA-Ketten von ihrem freien Ende abschneiden können, dh sie können DNA an jedem Punkt der Kette trennen.
Endonukleasen können DNA in jeder Region zufällig schneiden, ohne mit einer bestimmten Nukleotidsequenz übereinzustimmen.
Restriktionsendonukleasen
Restriktionsendonukleasen sind eine ganz besondere Art von Endonukleasen, die in der Lage sind, eine bestimmte Sequenz von Basen zu identifizieren, um die DNA-Kette an diesem bestimmten Punkt zu schneiden..
Sie werden in drei Gruppen eingeteilt: Typ I, Typ II und Typ III.
Restriktionsendonukleasen vom Typ I benötigen ATP, um zu funktionieren (wodurch Energie verbraucht wird) und sind in der Lage, bis zu 1000 Basenpaare von der Erkennungssequenz abzuspalten.
Die einfachste Version von Restriktionsendonukleasen ist Typ II; In einem Prozess, der keine Energie benötigt, können diese Enzyme DNA aus der Restriktionssequenz in variable Längen schneiden.
Schließlich schneiden Restriktionsendonukleasen vom Typ III in einem Prozess, der auch Energie verbraucht (ATP), die DNA-Kette in kleine Fragmente, die ab dem Zeitpunkt der Erkennung (Restriktion) 25 Basenpaare nicht überschreiten..
Exonukleasen
Schließlich sind Exonukleasen jene Enzyme, die in der Lage sind, DNA aus einem freien Ende der Kette herauszuschneiden, dh sie sind spezialisierte Enzyme in linearen DNA-Ketten, die zuvor durch Endonukleasen gespalten wurden..
Somit bezieht sich der Begriff ENDOnuklease auf die Fähigkeit des Enzyms, den DNA-Strang innerhalb zu schneiden (ENDO = innen), während EXOnuklease angibt, dass das Enzym DNA nur am freien Ende schneiden kann (EXO = außen).
Die synchronisierte und harmonische Aktivität all dieser Enzyme ermöglicht die komplexen Prozesse der genetischen Replikation und Transkription; Während der Nekrose geht dieses Gleichgewicht jedoch verloren und die DNA beginnt zu fragmentieren, bis nur noch ihre freien und unorganisierten Grundbestandteile übrig sind, was gleichbedeutend mit Zelltod ist..
Pathophysiologie der Karyolyse
Wenn man die große Anzahl der im Kern vorhandenen Enzyme sowie die Art und Weise kennt, in der sie ihre Funktion ausüben, ist es nicht schwierig, auf die Pathophysiologie der Karyolyse zu schließen.
Alles beginnt als Verlust der Homöostase zwischen Nukleaseenzymen und Ligasen, wobei die Wirkung der letzteren von den ersteren weit übertroffen wird; Das heißt, es wird mehr DNA zerstört, als repariert werden kann.
In erster Linie schneiden Endonukleasen eine lange DNA-Kette in kleine Fragmente, die anschließend durch andere Endonukleasen weiter reduziert werden..
Schließlich werden die kürzeren Fragmente von ihren Enden durch Exonukleasen lysiert, bis keine Spuren von organisiertem Kernmaterial mehr vorhanden sind, das enzymatisch zersetzt wurde..
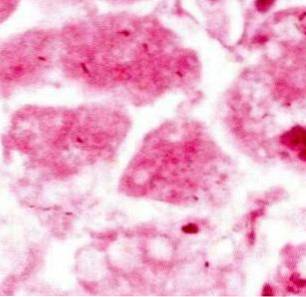
Befunde bei der Lichtmikroskopie
In der Lichtmikroskopie erscheinen Zellen, die einer Karyolyse unterzogen wurden, vollständig rosa (Eosinophile), was es unmöglich macht, lila gefärbtes Kernmaterial zu identifizieren.
In einigen Fällen kann ein abklingender Fleck oder "Geist" in dem Bereich gesehen werden, in dem sich einst der Zellkern befand, aber im Allgemeinen ist die vorherrschende Farbe rosa, da es keine organisierten Kernstrukturen mehr gibt, die Hämatoxylin einfangen können..
Verweise
- Van Cruchten, S. & Van Den Broeck, W. (2002). Morphologische und biochemische Aspekte von Apoptose, Onkose und Nekrose. Anatomie, Histologie, Embryologie, 31(4), 214 & ndash; 223.
- Parafiniuk, M. (1998). Phänomen der Karyolyse bei zytophotomorphometrischen Untersuchungen. Im Annales Academiae Medicae Stetinensis (S. 1-87).
- Tolbert, P. E., Shy, C. M. & Allen, J. W. (1992). Mikrokerne und andere nukleare Anomalien in bukkalen Abstrichen: Methodenentwicklung. Mutationsforschung / Umweltmutagenese und verwandte Themen, 271(1), 69-77.
- Levin, S., Bucci, T.J., Cohen, S.M., Fix, A.S., Hardisty, J.F., Legrand, E.K., ... & Trump, B.F. (1999). Die Nomenklatur des Zelltods: Empfehlungen eines Ad-hoc-Ausschusses der Society of Toxicologic Pathologists. Toxikologische Pathologie, 27(4), 484 & ndash; 490.
- Zabiti, S. (2002). Veränderung der ionischen Homöostase während einer durch metabolische Hypoxie induzierten Zellverletzung. Rolle einwertiger Ionen (Dissertation, Universität Granada).



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.