
Atommassendefinition, Typen, wie man sie berechnet, Beispiele

Das Atommasse ist die in einem Atom vorhandene Materiemenge, die in gewöhnlichen physikalischen Einheiten oder in Atommasseneinheiten (uma oder u) ausgedrückt werden kann. Ein Atom ist in seinem größten Teil seiner Struktur leer; Elektronen, die in Regionen diffundiert sind, die als Orbitale bezeichnet werden, in denen eine gewisse Wahrscheinlichkeit besteht, sie und ihren Kern zu finden.
Protonen und Neutronen befinden sich im Atomkern; Ersteres mit positiven Ladungen, letzteres mit neutralen Ladungen. Diese beiden subatomaren Teilchen haben eine Masse, die viel größer ist als die des Elektrons; Daher wird die Masse eines Atoms von seinem Kern und nicht vom Vakuum oder den Elektronen bestimmt.
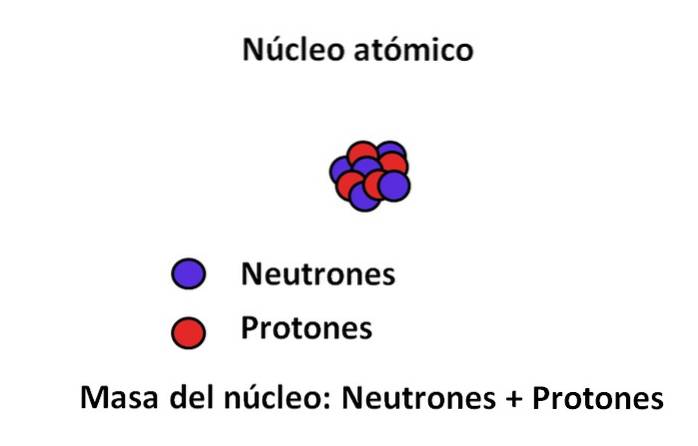
Die Masse eines Elektrons beträgt ungefähr 9.110-31 kg, während das des Protons 1,67 · 10-27 kg, das Massenverhältnis beträgt 1.800; Das heißt, ein Proton "wiegt" 1.800-mal mehr als ein Elektron. Ähnlich verhält es sich mit den Massen von Neutron und Elektron. Deshalb wird der Massenbeitrag des Elektrons für gewöhnliche Zwecke als vernachlässigbar angesehen..
Aus diesem Grund wird oft angenommen, dass die Masse des Atoms oder die Atommasse nur von der Masse des Kerns abhängt; was wiederum aus der Summe der Materie der Neutronen und Protonen besteht. Aus dieser Überlegung ergeben sich zwei Konzepte: Massenzahl und Atommasse, beide eng miteinander verbunden..
Es gibt so viel "Vakuum" in den Atomen, und da ihre Masse fast ausschließlich eine Funktion des Kerns ist, ist zu erwarten, dass letzterer außerordentlich dicht ist..
Wenn wir diesen Hohlraum von einem Körper oder Gegenstand entfernen, würden sich seine Abmessungen drastisch zusammenziehen. Wenn wir ein kleines Objekt auf der Basis von Atomkernen (ohne Elektronen) bauen könnten, hätte es eine Masse von Millionen Tonnen..
Andererseits helfen Atommassen dabei, verschiedene Atome desselben Elements zu unterscheiden. das sind die Isotope. Da es Isotope gibt, die häufiger vorkommen als andere, muss für ein bestimmtes Element ein Durchschnitt der Atommassen geschätzt werden. Durchschnitt, der von Planet zu Planet oder von einer räumlichen Region zur anderen variieren kann.
Artikelverzeichnis
- 1 Definition und Konzept
- 1.1 Atommasseneinheit
- 1.2 Äquivalenz in Gramm
- 2 Durchschnittliche Atommasse
- 2.1 Beispiel
- 3 Absolute Atommasse
- 4 Relative Atommasse
- 5 Berechnung der Atommasse
- 6 Beispiele
- 6.1 Kohlenstoff
- 6.2 Natrium
- 6.3 Sauerstoff
- 6.4 Stickstoff
- 6.5 Chlor
- 6.6 Dysprosium
- 7 Referenzen
Definition und Konzept
Per Definition ist die Atommasse die Summe der Massen ihrer Protonen und Neutronen, ausgedrückt mit uma oder u. Die resultierende Zahl (manchmal auch als Massenzahl bezeichnet) wird in der für Nuklide verwendeten Notation dimensionslos in der oberen linken Ecke platziert. Zum Beispiel für das Element fünfzehnX seine Atommasse ist 15uma oder 15u.
Die Atommasse kann nicht viel über die wahre Identität dieses Elements X aussagen. Stattdessen wird die Ordnungszahl verwendet, die den Protonen im Kern von X entspricht. Wenn diese Zahl 7 ist, ist die Differenz (15-7) gleich 8; Das heißt, X hat 7 Protonen und 8 Neutronen, deren Summe 15 ist.
Zurück zum Bild: Der Kern hat 5 Neutronen und 4 Protonen, sodass seine Massenzahl 9 beträgt. und 9 amu ist wiederum die Masse seines Atoms. Wenn man 4 Protonen hat und das Periodensystem konsultiert, kann man sehen, dass dieser Kern dem des Elements Beryllium Be (oder) entspricht 9Sein).
Atomare Masseneinheit
Atome sind zu klein, um ihre Masse mit herkömmlichen Methoden oder gewöhnlichen Waagen messen zu können. Aus diesem Grund wurde das uma, u oder Da (farbenblind) erfunden. Mit diesen für Atome entwickelten Einheiten können Sie sich ein Bild davon machen, wie massiv die Atome eines Elements im Verhältnis zueinander sind..
Aber was genau repräsentiert ein Amu? Es muss eine Referenz geben, mit der Massenbeziehungen hergestellt werden können. Hierzu wurde das Atom als Referenz verwendet 12C, das am häufigsten vorkommende und stabilste Isotop für Kohlenstoff. Mit 6 Protonen (seine Ordnungszahl Z) und 6 Neutronen beträgt seine Atommasse daher 12.
Es wird angenommen, dass Protonen und Neutronen die gleichen Massen haben, so dass jedes 1 amu beiträgt. Die Atommasseneinheit ist dann definiert als ein Zwölftel (1/12) der Masse eines Kohlenstoff-12-Atoms; Dies ist die Masse eines Protons oder Neutrons.
Äquivalenz in Gramm
Und jetzt stellt sich folgende Frage: Wie viele Gramm entspricht 1 amu? Da es anfangs nicht genügend fortgeschrittene Techniken gab, um es zu messen, mussten sich Chemiker damit zufrieden geben, alle Massen mit amu auszudrücken; Dies war jedoch ein Vorteil und kein Nachteil.
Warum? Weil subatomare Teilchen so klein sind, muss ihre Masse, ausgedrückt in Gramm, genauso klein gewesen sein. Tatsächlich entspricht 1 amu 1,6605 · 10-24 Gramm. Darüber hinaus war es unter Verwendung des Molkonzepts kein Problem, die Massen der Elemente und ihrer Isotope zu bearbeiten, wobei amu wusste, dass solche Einheiten auf g / mol modifiziert werden konnten.
Zum Beispiel zurück zu fünfzehnX und 9Wir haben, dass ihre Atommassen 15 amu bzw. 9 amu betragen. Da diese Einheiten so klein sind und nicht direkt angeben, wie viel Materie man "wiegen" muss, um sie zu manipulieren, werden sie in ihre jeweiligen Molmassen umgewandelt: 15 g / mol und 9 g / mol (Einführung in die Konzepte von Mol und Avogadro-Zahl ).
Durchschnittliche Atommasse
Nicht alle Atome desselben Elements haben die gleiche Masse. Dies bedeutet, dass sie mehr subatomare Partikel im Kern haben müssen. Da es sich um dasselbe Element handelt, muss die Ordnungszahl oder Anzahl der Protonen konstant bleiben. Daher gibt es nur Variationen in den Mengen an Neutronen, die sie besitzen.
So geht es aus der Definition von Isotopen hervor: Atome desselben Elements, aber mit unterschiedlichen Atommassen. Zum Beispiel besteht Beryllium fast ausschließlich aus dem Isotop 9Sei mit Spuren von 10Sein. Dieses Beispiel ist jedoch nicht sehr hilfreich, um das Konzept der durchschnittlichen Atommasse zu verstehen. Wir brauchen eins mit mehr Isotopen.
Beispiel
Angenommen, das Element existiert 88J, dies ist das Hauptisotop von J mit einer Häufigkeit von 60%. J hat auch zwei andere Isotope: 86J mit einer Häufigkeit von 20% und 90J, mit einer Häufigkeit von ebenfalls 20%. Dies bedeutet, dass von 100 J Atomen, die wir auf der Erde sammeln, 60 sind 88J und die restlichen 40 eine Mischung aus 86J und 90J..
Jedes der drei Isotope von J hat seine eigene Atommasse; das heißt, ihre Summe von Neutronen und Protonen. Diese Massen müssen jedoch gemittelt werden, um eine Atommasse für J zur Hand zu haben; hier auf der Erde, wie es andere Regionen des Universums geben kann, in denen die Fülle von 86J ist 56% und nicht 60%.
Um die durchschnittliche Atommasse von J zu berechnen, muss der gewichtete Durchschnitt der Massen seiner Isotope erhalten werden; das heißt, unter Berücksichtigung des Prozentsatzes der Fülle für jeden von ihnen. So haben wir:
Durchschnittliche Masse (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Das heißt, die durchschnittliche Atommasse (auch als Atomgewicht bekannt) von J beträgt 87,2 amu. Mittlerweile beträgt seine Molmasse 87,2 g / mol. Beachten Sie, dass 87,2 näher an 88 als an 86 liegt und auch von 90 entfernt ist.
Absolute Atommasse
Die absolute Atommasse ist die in Gramm ausgedrückte Atommasse. Ausgehend vom Beispiel des hypothetischen Elements J können wir seine absolute Atommasse (die des Durchschnitts) berechnen, wobei wir wissen, dass jede Amu 1,6605 · 10 entspricht-24 Gramm:
Absolute Atommasse (J) = 87,2 amu * (1,6605 · 10-24 g / am)
= 1,447956 10-22 g / Atom J.
Dies bedeutet, dass die J-Atome im Durchschnitt eine absolute Masse von 1,447956 · 10 haben-22 G.
Relative Atommasse
Die relative Atommasse ist numerisch identisch mit der durchschnittlichen Atommasse für ein bestimmtes Element; Im Gegensatz zum zweiten fehlt dem ersten jedoch die Einheit. Daher ist es dimensionslos. Beispielsweise beträgt die durchschnittliche Atommasse von Beryllium 9,012182 u; während seine relative Atommasse einfach 9,012182 beträgt.
Deshalb werden diese Konzepte manchmal als Synonyme falsch interpretiert, da sie sehr ähnlich sind und die Unterschiede zwischen ihnen subtil sind. Aber worauf beziehen sich diese Massen? Bezogen auf ein Zwölftel der Masse der 12C..
Ein Element mit einer relativen Atommasse von 77 bedeutet also, dass es eine 77-mal größere Masse als 1/12 der hat 12C..
Diejenigen, die sich die Elemente im Periodensystem angesehen haben, werden feststellen, dass ihre Massen relativ ausgedrückt sind. Sie haben keine Amu-Einheiten und es wird interpretiert als: Eisen hat eine Atommasse von 55.846, was bedeutet, dass es 55.846-mal mehr Masse ist als die Masse von 1/12 der 12C, und das kann auch als 55,846 amu oder 55,846 g / mol ausgedrückt werden.
Wie berechnet man die Atommasse?
Mathematisch wurde ein Beispiel gegeben, wie man es am Beispiel von Element J berechnet. Im Allgemeinen muss die gewichtete Durchschnittsformel angewendet werden, die wäre:
P = Σ (Isotopenatommasse) (Häufigkeit in Dezimalstellen)
Mit anderen Worten, wenn die Atommassen (Neutronen + Protonen) jedes Isotops (normalerweise natürlich) für ein gegebenes Element sowie ihre jeweiligen terrestrischen Häufigkeiten (oder was auch immer die betrachtete Region ist) vorliegen, kann der gewichtete Durchschnitt berechnet werden..
Und warum nicht nur der arithmetische Durchschnitt? Zum Beispiel beträgt die durchschnittliche Atommasse von J 87,2 amu. Wenn wir diese Masse noch einmal berechnen, aber arithmetisch, haben wir:
Durchschnittliche Masse (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Beachten Sie, dass es einen wichtigen Unterschied zwischen 88 und 87,2 gibt. Dies liegt daran, dass der arithmetische Durchschnitt davon ausgeht, dass die Häufigkeit aller Isotope gleich ist. Da es drei Isotope von J gibt, sollte jedes eine Häufigkeit von 100/3 (33,33%) haben. Dies ist jedoch in der Realität nicht der Fall: Es gibt viel mehr Isotope als andere.
Deshalb wird der gewichtete Durchschnitt berechnet, da er berücksichtigt, wie häufig ein Isotop in Bezug auf ein anderes ist..
Beispiele
Kohlenstoff
Um die durchschnittliche Atommasse von Kohlenstoff zu berechnen, benötigen wir seine natürlichen Isotope mit ihren jeweiligen Häufigkeiten. Im Fall von Kohlenstoff sind dies: 12C (98,89%) und 13C (1,11%). Ihre relativen Atommassen betragen 12 bzw. 13, was wiederum 12 amu und 13 amu entspricht. Lösen:
Durchschnittliche Atommasse (C) = (12 amu) (0,9889) + (13 amu) (0,0111)
= 12.0111 amu
Daher beträgt die Masse eines Kohlenstoffatoms durchschnittlich 12,01 amu. Da gibt es Spurenmengen von 14C hat fast keinen Einfluss auf diesen Durchschnitt.
Natrium
Alle terrestrischen Natriumatome bestehen aus dem Isotop 2. 3Na, also ist seine Häufigkeit 100%. Deshalb kann bei gewöhnlichen Berechnungen angenommen werden, dass seine Masse einfach 23 amu oder 23 g / mol beträgt. Die genaue Masse beträgt jedoch 22,98976928 amu.
Sauerstoff
Die drei Sauerstoffisotope mit ihrer jeweiligen Häufigkeit sind: 16O (99,762%), 17O (0,038%) und 18O (0,2%). Wir haben alles, um die durchschnittliche Atommasse zu berechnen:
Durchschnittliche Atommasse (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16.00438 amu
Obwohl seine gemeldete genaue Masse tatsächlich 15.9994 amu beträgt.
Stickstoff
Wiederholen Sie die gleichen Schritte mit Sauerstoff, die wir haben: 14N (99,634%) und fünfzehnN (0,366%). Dann:
Durchschnittliche Atommasse (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14.00366 amu
Beachten Sie, dass die angegebene Masse für Stickstoff 14.0067 amu beträgt, etwas höher als die von uns berechnete.
Chlor
Die Isotope von Chlor mit ihren jeweiligen Häufigkeiten sind: 35Cl (75,77%) und 37Cl (24,23%). Berechnung der durchschnittlichen Atommasse haben wir:
Durchschnittliche Atommasse (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Sehr ähnlich zu dem berichteten (35.453 amu).
Dysprosium
Und schließlich wird die durchschnittliche Masse eines Elements mit vielen natürlichen Isotopen berechnet: Dysprosium. Diese und mit ihren jeweiligen Häufigkeiten sind: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) und 164Dy (28,18%).
Wir gehen wie in den vorherigen Beispielen vor, um die Atommasse dieses Metalls zu berechnen:
Durchschnittliche Atommasse (Dy) = (156 amu) (0,0006%) + (158 amu) (0,0010) + (160 amu) (0,0234) + (161 amu) (0,1891) + (162 amu) (0,2551) + (163) amu) (0,2490) + (164 amu) (0,2818)
= 162,5691 amu
Die gemeldete Masse beträgt 162.500 amu. Beachten Sie, dass dieser Durchschnitt zwischen 162 und 163 liegt, da die Isotope 156Dy, 158Dy und 160Dy sind wenige reichlich vorhanden; während diejenigen, die vorherrschen, sind 162Dy, 163Dy und 164Dy.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2019). Atommasse. Wiederhergestellt von: en.wikipedia.org
- Christopher Masi. (s.f.). Atommasse. Wiederhergestellt von: wsc.mass.edu
- Natalie Wolchover. (12. September 2017). Wie wiegt man ein Atom? Live Science. Wiederhergestellt von: lifescience.com
- Chemie LibreTexts. (05. Juni 2019). Berechnung der Atommassen. Wiederhergestellt von: chem.libretexts.orgs
- Edward Wichers und H. Steffen Peiser. (15. Dezember 2017). Atomares Gewicht. Encyclopædia Britannica. Wiederhergestellt von: britannica.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.