
Isochore Prozessformeln und Berechnung, alltägliche Beispiele

EIN isochorischer Prozess Es sind alles thermodynamische Prozesse, bei denen das Volumen konstant bleibt. Diese Prozesse werden oft auch als isometrisch oder isovolumetrisch bezeichnet. Im Allgemeinen kann ein thermodynamischer Prozess bei konstantem Druck ablaufen und wird daher als isobar bezeichnet.
Wenn es bei konstanter Temperatur auftritt, spricht man in diesem Fall von einem isothermen Prozess. Wenn es keinen Wärmeaustausch zwischen dem System und der Umgebung gibt, spricht man von adiabatisch. Wenn andererseits ein konstantes Volumen vorhanden ist, wird der erzeugte Prozess als isochor bezeichnet.
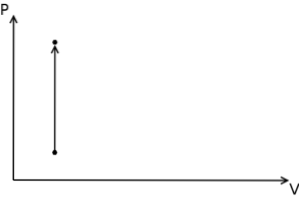
Im Fall des isochoren Prozesses kann festgestellt werden, dass bei diesen Prozessen die Druck-Volumen-Arbeit Null ist, da dies aus der Multiplikation des Drucks mit der Volumenzunahme resultiert.
Darüber hinaus werden in einem thermodynamischen Druck-Volumen-Diagramm die isochoren Prozesse in Form einer vertikalen Geraden dargestellt..
Artikelverzeichnis
- 1 Formeln und Berechnung
- 1.1 Das erste Prinzip der Thermodynamik
- 2 Alltagsbeispiele
- 2.1 Der ideale Otto-Zyklus
- 3 Praktische Beispiele
- 3.1 Erstes Beispiel
- 3.2 Zweites Beispiel
- 4 Referenzen
Formeln und Berechnung
Das erste Prinzip der Thermodynamik
In der Thermodynamik wird die Arbeit aus dem folgenden Ausdruck berechnet:
W = P ∙ ∆ V.
In diesem Ausdruck ist W die in Joule gemessene Arbeit, P der in Newton pro Quadratmeter gemessene Druck und ∆ V die in Kubikmetern gemessene Änderung oder Zunahme des Volumens..
Ebenso legt das sogenannte erste Prinzip der Thermodynamik fest, dass:
∆ U = Q - W.
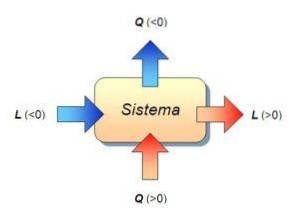
In dieser Formel ist W die vom System oder am System geleistete Arbeit, Q ist die vom System empfangene oder abgegebene Wärme und ∆ U. ist die interne Energievariation des Systems. Bei dieser Gelegenheit werden die drei Größen in Joule gemessen.
Da in einem isochoren Prozess die Arbeit null ist, stellt sich heraus, dass:
∆ U = Q.V. (da ∆ V = 0 und damit W = 0 ist)
Mit anderen Worten, die Variation der inneren Energie des Systems ist ausschließlich auf den Wärmeaustausch zwischen dem System und der Umgebung zurückzuführen. In diesem Fall wird die übertragene Wärme als Wärme mit konstantem Volumen bezeichnet..
Die Wärmekapazität eines Körpers oder Systems ergibt sich aus der Aufteilung der Energiemenge in Form von Wärme, die in einem bestimmten Prozess auf einen Körper oder ein System übertragen wird, und der Temperaturänderung, die dieser erfährt..
Wenn der Prozess bei konstantem Volumen durchgeführt wird, spricht man von Wärmekapazität bei konstantem Volumen und es wird mit C bezeichnetv (molare Wärmekapazität).
Es wird in diesem Fall erfüllt:
Q.v = n ≤ C.v ∙ ∆T
In dieser Situation ist n die Anzahl der Mol, C.v ist die oben erwähnte molare Wärmekapazität bei konstantem Volumen und ∆T ist der Temperaturanstieg, den der Körper oder das System erfährt.
Alltagsbeispiele
Man kann sich leicht einen isochoren Prozess vorstellen, man muss nur an einen Prozess denken, der mit konstantem Volumen abläuft. das heißt, in dem der Behälter, der die Materie oder das Materialsystem enthält, sein Volumen nicht ändert.
Ein Beispiel könnte der Fall eines (idealen) Gases sein, das in einem geschlossenen Behälter eingeschlossen ist, dessen Volumen auf keine Weise verändert werden kann, der Wärme zugeführt wird. Angenommen, es handelt sich um ein in einer Flasche eingeschlossenes Gas.
Wenn Wärme, wie bereits erläutert, auf das Gas übertragen wird, führt dies zu einer Erhöhung oder Erhöhung seiner inneren Energie.
Der umgekehrte Vorgang wäre der eines Gases, das in einem Behälter eingeschlossen ist, dessen Volumen nicht verändert werden kann. Wenn das Gas gekühlt wird und Wärme an die Umgebung abgibt, würde der Druck des Gases verringert und der Wert der inneren Energie des Gases würde abnehmen.
Der ideale Otto-Zyklus
Der Otto-Zyklus ist ein Idealfall für den Zyklus, der von Benzinmaschinen verwendet wird. Die anfängliche Verwendung erfolgte jedoch in Maschinen, die Erdgas oder andere Arten von Brennstoffen in gasförmigem Zustand verwendeten..
In jedem Fall ist Ottos idealer Zyklus ein interessantes Beispiel für einen isochoren Prozess. Es tritt auf, wenn in einem Verbrennungsauto die Verbrennung des Benzin-Luft-Gemisches augenblicklich stattfindet.
In diesem Fall steigt die Temperatur und der Druck des Gases in der Flasche an, wobei das Volumen konstant bleibt..
Praktische Beispiele
Erstes Beispiel
Geben Sie bei einem (idealen) Gas, das in einem mit einem Kolben ausgestatteten Zylinder eingeschlossen ist, an, ob die folgenden Fälle Beispiele für isochore Prozesse sind.
- 500 J Arbeiten werden am Gas durchgeführt.
In diesem Fall wäre es kein isochorer Prozess, da es zur Durchführung von Arbeiten am Gas erforderlich ist, es zu komprimieren und daher sein Volumen zu ändern.
- Das Gas dehnt sich aus, indem es den Kolben horizontal verschiebt.
Auch hier wäre es kein isochorer Prozess, da die Expansion des Gases eine Änderung seines Volumens impliziert.
- Der Zylinderkolben ist so fixiert, dass er sich nicht bewegen kann und das Gas gekühlt wird.
Diesmal wäre es ein isochorer Prozess, da es keine Volumenschwankungen geben würde.
Zweites Beispiel
Bestimmen Sie die Variation der inneren Energie, die ein Gas in einem Behälter mit einem Volumen von 10 l, das 1 atm Druck ausgesetzt ist, erfährt, wenn seine Temperatur in einem isochoren Prozess, der als molare spezifische Wärme bezeichnet wird, von 34 ° C auf 60 ° C ansteigt. C.v = 2,5R. (Sein R. = 8,31 J / mol K).
Da es sich um einen Prozess mit konstantem Volumen handelt, tritt die interne Energieänderung nur als Folge der dem Gas zugeführten Wärme auf. Dies wird mit folgender Formel bestimmt:
Q.v = n ∙ C.v ∙ ∆T
Um die zugeführte Wärme zu berechnen, müssen zunächst die im Behälter enthaltenen Mol Gas berechnet werden. Hierzu muss auf die ideale Gasgleichung zurückgegriffen werden:
P ∙ V = n ∙ R ∙ T.
In dieser Gleichung ist n die Anzahl der Mol, R ist eine Konstante, deren Wert 8,31 J / molK beträgt, T ist die Temperatur, P ist der Druck, dem das Gas ausgesetzt ist, gemessen in Atmosphären und T ist die in Kelvin gemessene Temperatur.
Löse nach n und erhalte:
n = R ≤ T / (P ≤ V) = 0,39 Mol
So dass:
∆ U = Q.V. = n ∙ C.v ≤ T = 0,39 ≤ 2,5 ≤ 8,31 ≤ 26 = 210,65 J.
Verweise
- Resnik, Halliday & Krane (2002). Physik Band 1. Cecsa.
- Laider, Keith, J. (1993). Oxford University Press, hrsg. Die Welt der physikalischen Chemie.
- Wärmekapazität. (n.d.). In Wikipedia. Abgerufen am 28. März 2018 von en.wikipedia.org.
- Latente Hitze. (n.d.). In Wikipedia. Abgerufen am 28. März 2018 von en.wikipedia.org.
- Isochorischer Prozess. (n.d.). In Wikipedia. Abgerufen am 28. März 2018 von en.wikipedia.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.