
Meniskus (Chemie), woraus es besteht und welche Typen es hat
Das Meniskus ist die Krümmung der Oberfläche einer Flüssigkeit. Es ist auch die freie Oberfläche einer Flüssigkeit an der Flüssigkeits-Luft-Grenzfläche. Flüssigkeiten zeichnen sich durch ein festes Volumen aus, das schlecht komprimierbar ist.
Die Form von Flüssigkeiten variiert jedoch, indem sie die Form des Behälters annehmen, in dem sie enthalten sind. Diese Eigenschaft beruht auf der zufälligen Bewegung der Moleküle, aus denen sie bestehen..

Flüssigkeiten können fließen, haben eine hohe Dichte und diffundieren schnell in andere Flüssigkeiten, mit denen sie mischbar sind. Sie nehmen durch die Schwerkraft den untersten Bereich des Behälters ein und hinterlassen oben eine nicht ganz flache freie Oberfläche. Unter bestimmten Umständen können sie spezielle Formen wie Tropfen, Blasen und Blasen annehmen..
Die Eigenschaften von Flüssigkeiten wie Schmelzpunkt, Dampfdruck, Viskosität und Verdampfungswärme hängen von der Intensität der intermolekularen Kräfte ab, die den Zusammenhalt der Flüssigkeiten bewirken..
Flüssigkeiten interagieren jedoch auch durch Adhäsionskräfte mit dem Behälter. Der Meniskus entsteht dann aus diesen physikalischen Phänomenen: dem Unterschied zwischen den Kohäsionskräften zwischen den Partikeln der Flüssigkeit und denen der Adhäsion, die es ihnen ermöglichen, die Wände zu benetzen..
Artikelverzeichnis
- 1 Was ist der Meniskus??
- 1.1 Kohäsionskräfte
- 1.2 Adhäsionskräfte
- 2 Arten von Menisken
- 2.1 Konkav
- 2.2 Konvex
- 3 Oberflächenspannung
- 4 Kapillarität
- 5 Referenzen
Was ist der Meniskus??
Wie gerade erläutert, ist der Meniskus das Ergebnis verschiedener physikalischer Phänomene, unter denen auch die Oberflächenspannung der Flüssigkeit erwähnt werden kann..
Kohäsionskräfte
Kohäsionskräfte sind der physikalische Begriff, der die intermolekularen Wechselwirkungen innerhalb der Flüssigkeit erklärt. Im Fall von Wasser sind die Kohäsionskräfte auf die Dipol-Dipol-Wechselwirkung und Wasserstoffbrücken zurückzuführen.
Das Wassermolekül ist bipolarer Natur. Dies ist auf die Tatsache zurückzuführen, dass der Sauerstoff im Molekül elektronegativ ist, da er eine größere Avidität für Elektronen aufweist als Wasserstoff, was bestimmt, dass der Sauerstoff negativ geladen ist und die Wasserstoffatome positiv geladen sind..
Es gibt eine elektrostatische Anziehungskraft zwischen der negativen Ladung eines Wassermoleküls auf Sauerstoff und der positiven Ladung eines anderen Wassermoleküls auf Wasserstoff..
Diese Wechselwirkung ist als Dipol-Dipol-Wechselwirkung oder Kraft bekannt, die zur Kohäsion der Flüssigkeit beiträgt..
Adhäsionskräfte
Andererseits können Wassermoleküle mit Glaswänden interagieren, indem sie die Wasserstoffatome der Wassermoleküle, die stark an die Sauerstoffatome auf der Oberfläche des Glases binden, teilweise aufladen..
Dies stellt die Adhäsionskraft zwischen der Flüssigkeit und der starren Wand dar; umgangssprachlich heißt es, dass die Flüssigkeit die Wand benetzt.
Wenn eine Silikonlösung auf die Oberfläche des Glases gegeben wird, imprägniert das Wasser das Glas nicht vollständig, sondern es bilden sich Tröpfchen auf dem Glas, die leicht entfernt werden können. Somit wird angezeigt, dass mit dieser Behandlung die Adhäsionskraft zwischen Wasser und Glas verringert wird..
Ein sehr ähnlicher Fall tritt auf, wenn die Hände fettig sind und wenn sie in Wasser gewaschen werden, können sehr definierte Tropfen auf der Haut anstelle einer feuchten Haut gesehen werden.
Arten von Menisken
Es gibt zwei Arten von Menisken: die konkave und die konvexe. Im Bild ist die Konkavität A und die Konvexität B. Die gepunkteten Linien geben den korrekten Pegel beim Lesen einer Volumenmessung an.
Konkav
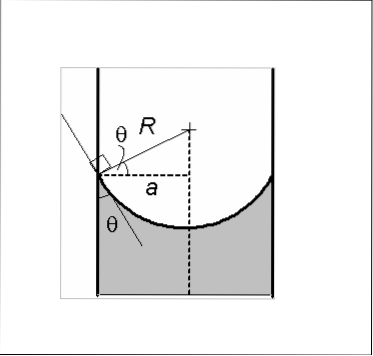
Der konkave Meniskus ist dadurch gekennzeichnet, dass der Kontaktwinkel θ, der durch die Glaswand mit einer zum Meniskus tangentialen Linie gebildet wird und in die Flüssigkeit eingeführt wird, einen Wert von weniger als 90º aufweist. Wenn eine Menge der Flüssigkeit auf das Glas gegeben wird, neigt sie dazu, sich über die Oberfläche des Glases auszubreiten..
Das Vorhandensein eines konkaven Meniskus zeigt, dass die Kohäsionskräfte in der Flüssigkeit geringer sind als die Adhäsionskraft der Flüssigglaswand.
Daher badet oder benetzt die Flüssigkeit die Glaswand, hält eine Menge Flüssigkeit zurück und verleiht dem Meniskus eine konkave Form. Wasser ist ein Beispiel für eine Flüssigkeit, die konkave Menisken bildet.
Konvex
Im Fall des konvexen Meniskus hat der Kontaktwinkel θ einen Wert größer als 90º. Quecksilber ist ein Beispiel für eine Flüssigkeit, die konvexe Menisken bildet. Wenn ein Tropfen Quecksilber auf eine Glasoberfläche gegeben wird, hat der Kontaktwinkel θ einen Wert von 140º.
Die Beobachtung eines konvexen Meniskus zeigt, dass die Kohäsionskräfte der Flüssigkeit größer sind als die Adhäsionskraft zwischen der Flüssigkeit und der Glaswand. Es wird gesagt, dass die Flüssigkeit das Glas nicht benetzt.
Die Oberflächenkräfte von Kohäsion (Flüssigkeit-Flüssigkeit) und Adhäsion (Flüssigkeit-Feststoff) sind für viele Phänomene von biologischem Interesse verantwortlich. Dies ist der Fall bei Oberflächenspannung und Kapillarität.
Oberflächenspannung
Die Oberflächenspannung ist eine Nettoanziehungskraft, die auf die Moleküle der Flüssigkeit auf der Oberfläche ausgeübt wird und dazu neigt, sie in die Flüssigkeit einzuführen..
Daher neigt die Oberflächenspannung dazu, die Flüssigkeit zu verschmelzen und ihnen konkavere Menisken zu geben; Oder anders ausgedrückt: Diese Kraft neigt dazu, die Oberfläche der Flüssigkeit von der Glaswand zu entfernen.
Die Oberflächenspannung neigt dazu, mit steigender Temperatur abzunehmen, zum Beispiel: Die Oberflächenspannung von Wasser beträgt 0,076 N / m bei 0 ° C und 0,059 N / m bei 100 ° C..
Währenddessen beträgt die Oberflächenspannung von Quecksilber bei 20 ° C 0,465 N / m. Dies würde erklären, warum Quecksilber konvexe Menisken bildet.
Kapillarität
Wenn der Kontaktwinkel & thgr; weniger als 90 ° beträgt und die Flüssigkeit die Glaswand benetzt, kann die Flüssigkeit in den Glaskapillaren zu einem Gleichgewichtszustand aufsteigen.
Das Gewicht der Flüssigkeitssäule wird durch die vertikale Komponente der Kohäsionskraft aufgrund der Oberflächenspannung ausgeglichen. Die Adhäsionskraft greift nicht ein, da sie senkrecht zur Oberfläche des Rohrs stehen.
Dieses Gesetz erklärt nicht, wie Wasser durch die Gefäße des Xylems von den Wurzeln zu den Blättern aufsteigen kann..
Tatsächlich gibt es andere Faktoren, die diesbezüglich eingreifen, zum Beispiel: Wenn das Wasser in den Blättern verdunstet, können die Wassermoleküle im oberen Teil der Kapillaren angesaugt werden.
Dadurch können andere Moleküle vom Boden der Kapillaren aufsteigen und die Stelle der verdampften Wassermoleküle einnehmen..
Verweise
- Ganong, W. F. (2002). Medizinische Physiologie. 2002. 19. Ausgabe. Modernes Handbuch Editorial.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Helmenstine, Anne Marie, Ph.D. (4. August 2018). Wie man einen Meniskus in der Chemie liest. Wiederhergestellt von :oughtco.com
- Wikipedia. (2018). Meniskus (flüssig). Wiederhergestellt von: en.wikipedia.org
- Friedl S. (2018). Was ist ein Meniskus? Studie. Wiederhergestellt von: study.com
- Oberflächenspannung. Wiederhergestellt von: chem.purdue.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.