
Peroxideigenschaften, Nomenklatur, Verwendungen, Beispiele
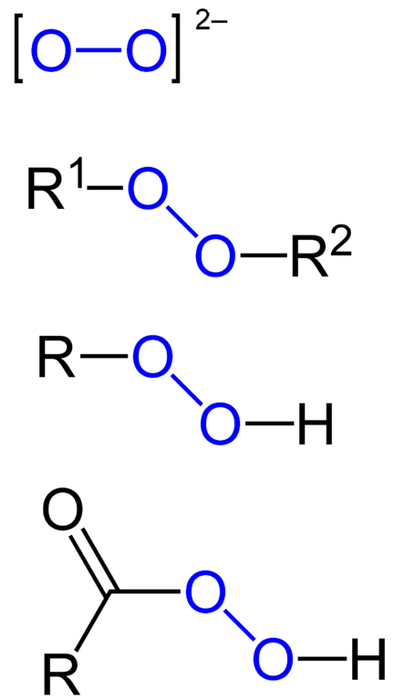
Das Peroxide sind alle chemischen Verbindungen, die die Peroxogruppe O-O enthalten, entweder kovalent an Kohlenstoffatome oder andere funktionelle Gruppen gebunden oder in ionischer Form wie das Peroxidanion O.zweizwei-. Das Obige ist im Bild unten grafisch dargestellt. Darin wird die Gruppe O-O mit einer blauen Farbe hervorgehoben.
Es können organische Peroxide wie Diakylperoxide (R.1-O-O-Rzwei), Hydroperoxide (R-O-O-H), Persäuren (RCO-O-O-H) und Perester (R.1CO-O-O-Rzwei). Wir haben auch anorganische Peroxide wie Metallperoxide (M.n+ODERzweizwei-) und Wasserstoffperoxid (H-O-O-H). Letzteres ist das bekannteste von allen und erhält den Namen Wasserstoffperoxid.
Allen Peroxiden ist gemeinsam, dass sie hochreaktive, oxidierende und in einigen Fällen explosive Substanzen sind. Sofern sie nicht synthetisiert werden, gelten sie für viele industrielle Prozesse und für die Laborsynthese als unerwünschte und gefährliche Verunreinigungen..
Peroxide sind im Allgemeinen ausgezeichnete Oxidations-, Bleich-, bakterizide Mittel und Aktivatoren von Polymerisationen über die Bildung freier Radikale. Deshalb sind sie normalerweise sehr nützliche Reagenzien oder Additive in der Polymerindustrie sowie in der Lebensmittelindustrie, um die Oxidation zu beschleunigen und Bakterien zu eliminieren..
Artikelverzeichnis
- 1 Eigenschaften von Peroxiden
- 1.1 Struktur
- 1.2 Reaktivität
- 1.3 Oxidationswirkung
- 1.4 Empfindlichkeit
- 2 Nomenklatur
- 3 Schulung
- 4 Verwendung von Peroxiden
- 4.1 Polymerisationsinitiatoren
- 4.2 Bleichmittel und Desinfektionsmittel
- 4.3 Oxidationsmittel
- 4.4 Sauerstoffquellen
- 5 Beispiele für Peroxide
- 6 Referenzen
Eigenschaften von Peroxiden
Struktur
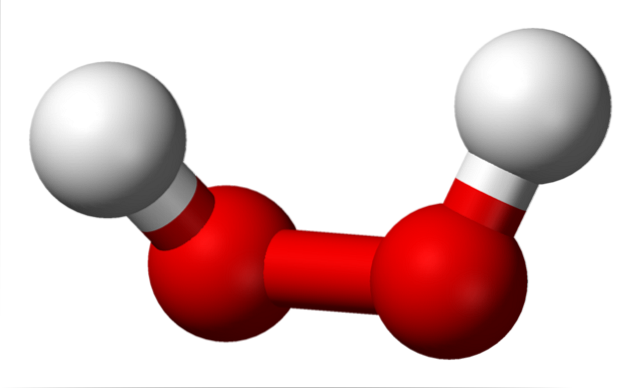
Die Strukturen der Peroxide sind um die O-O-Gruppe zentriert. Jedes Sauerstoffatom hat eine sp-Hybridisierung3, Die -O-O- -Links ruhen also nicht auf derselben Ebene. Beispielsweise beträgt für Wasserstoffperoxid H-O-O-H der zwischen den beiden Hs gebildete Winkel 115,5º, was zeigt, dass sich die vier Atome nicht in einer Ebene befinden..
Die Verzerrungen dieses und anderer Winkel hängen von der Identität der anderen molekularen Fragmente ab, die an die O-O-Gruppe gebunden sind..
Andererseits können organische und anorganische Peroxide (mit Ausnahme von metallischen) mit bloßem Auge erkannt werden, wenn die O-O-Gruppe in ihrer Struktur detailliert ist, wie zwei Gläser mit einem „Mund“. Auf diese Weise wird jedes Peroxid sofort mit einem Blick auf seine Struktur identifiziert..
Reaktivität
Die O-O-Bindung ist im Vergleich zu anderen Bindungen wie C-H oder C-O relativ schwach. Deshalb neigt es dazu, sich zu zersetzen oder zu fragmentieren, um hochreaktive sauerstoffhaltige Radikale zu erzeugen..
Aufgrund dieser Radikale werden Peroxide als reaktive und gefährliche Substanzen eingestuft, da sie Gewebe und organische Stoffe im Allgemeinen schädigen können..
Oxidierende Wirkung
Peroxide sind starke Oxidationsmittel, die versuchen, Elektronen aus der Umgebung zu gewinnen, um sie in Wasser, Sauerstoff oder Hydroxide umzuwandeln. Beispielsweise ist Wasserstoffperoxid ein stärkeres Oxidationsmittel als Kaliumpermanganat selbst..
Diese oxidierende Wirkung wird verwendet, um sie durch ihre Reaktion mit Eisensulfat und Kaliumthiocyanat nachzuweisen:
Peroxid + Fezwei+ + SCN- → Fe (SCN)n(3-n)- (n = 1 bis 6).
Der zwischen dem Fe gebildete Komplex3+ und die SNA- Die Farbe ist blutrot, daher entspricht die Beobachtung dieser Farbe einem positiven Test auf das Vorhandensein von Peroxiden in der Probe.
Empfindlichkeit
Peroxide sind Substanzen, die empfindlich gegen hohe Temperaturen und Sonnenlicht sind. Daher sollten sie an sicheren Orten und in undurchsichtigen Plastikbehältern so gelagert werden, dass kein Licht direkt auf sie fällt..
Nomenklatur
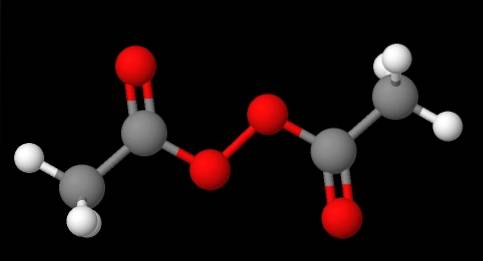
Die Nomenklatur der Peroxide hängt davon ab, zu welchem Typ sie gehören. Im Allgemeinen werden viele durch Erwähnung von "Peroxid" gefolgt von den R-Substituenten in alphabetischer Reihenfolge benannt. Zum Beispiel die Verbindung CH3C (O) OOC (O) CH3 (unteres Bild) wird als Diacetyl- oder Acetylperoxid bezeichnet, da es an jedem Ende eine Acetylgruppe aufweist.
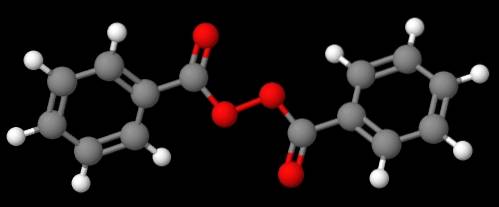
Verbindung C.6H.5C (O) OOC (O) C.6H.5 (unteres Bild) wird es andererseits aus den gleichen Gründen, die im vorhergehenden Absatz erläutert wurden, Dibenzoyl oder Benzoylperoxid genannt.
Inzwischen Verbindung C.6H.5C (O) OOC (O) CH3 Es heißt Acetylbenzoylperoxid. Diesmal wird der Acetylsubstituent zuerst erwähnt, indem mit dem Buchstaben 'a' begonnen wird. Ein weiteres Beispiel ist der CH3CHzweiOOC6H.5, Ethylphenylperoxid genannt.
In ähnlicher Weise verfahren wir mit den Hydroperoxiden. Zum Beispiel der CH3OOH heißt Methylhydroperoxid.
Ausbildung
Einige Peroxide können direkt durch Aussetzen der betreffenden Substanz mit Luftsauerstoff gebildet werden, unterstützt oder nicht mit metallischen Katalysatoren. Sie können auch gebildet werden, indem die Substanz unter bestimmten Bedingungen Ozon ausgesetzt wird und die Ozonolysereaktion durchgeführt wird..
Ein anderer Syntheseweg besteht darin, Wasserstoffperoxid mit einem Alkylsulfat zu reagieren:
R.zweiSW4 + H.zweiODERzwei → R-O-O-R + H.zweiSW4
Um Dialkylperoxide oder sogar cyclische Peroxide zu synthetisieren oder zu bilden.
In der Zwischenzeit basieren einige der Verfahren zur Bildung von Metallperoxiden auf der Sauerstoffanreicherung ihrer jeweiligen Metalloxide, so dass sie "sauerstoffhaltig" werden und nicht mehr MO (M) sindn+ODERzwei-) Liebezwei (M.n+ODERzweizwei-).
Verwendung von Peroxiden
Polymerisationsinitiatoren
Peroxide, insbesondere organische Peroxide, werden Reaktionsmedien zur Synthese von Unendlichkeiten von Kunststoffen und Materialien wie Polystyrol, Silikon, Epoxid- und Acrylharzen, Polyvinylchlorid, Glasfaser usw. zugesetzt.
Dies liegt daran, dass sie thermisch zersetzt werden, um sauerstoffhaltige freie Radikale zu werden, die wiederum Polymerisationen auslösen und katalysieren. Daher sind sie in der Polymerindustrie wünschenswert..
Einige der als Initiatoren verwendeten Peroxide sind Methylethylketon (MEK) -Peroxid und Acetonperoxid.
Bleichmittel und Desinfektionsmittel
Peroxide sind Bleichmittel, die zum Bleichen von Papierzellstoff und Mehl verwendet werden. Ebenso sind sie Desinfektionsmittel, die völlig wirksam sind, obwohl sie hinsichtlich der Ausrottung von Bakterien aggressiv sind. Das klassische Beispiel entspricht Wasserstoffperoxid, das in verdünnten Lösungen (3%) zur Desinfektion von Wunden verwendet wird..
Oxidationsmittel
Peroxide sind auch Oxidationsmittel, weshalb sie in der organischen Synthese hochsauerstoffhaltiger Substanzen vielfältige Verwendung finden..
Sauerstoffquellen
Obwohl es nicht zu seinen Hauptanwendungen gehört, können Peroxide bei einigen seiner Zersetzungen auch als Sauerstoffquellen dienen. Dies ist wiederum bei Wasserstoffperoxid der Fall.
Beispiele für Peroxide
Schließlich werden einige Beispiele für Peroxide, ob organisch oder anorganisch, mit ihren Formeln und jeweiligen Namen aufgeführt:
-H.zweiODERzwei: Wasserstoffperoxid oder Wasserstoffperoxid
-N / AzweiODERzwei: Natriumperoxid
-Strahlzwei: Bariumperoxid
-C.6H.5C (CH3)zweiOOH: Cumolhydroperoxid
-(NH4)zweiS.zweiODER8: Ammonium Persulfat
- HO3SOO SO3H: Peroxydisulfonsäure
-(CH3)3COOC (CH3)3: Ditert-Butylperoxid
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Organisches Peroxid. Wiederhergestellt von: en.wikipedia.org
- Elsevier B.V. (2020). Peroxid. ScienceDirect. Wiederhergestellt von: sciencedirect.com
- Fortgeschrittene Chemieentwicklung. (s.f.). Alkohole, Phenole und ihre Derivate:
- Peroxide Regel C-218. Wiederhergestellt von: acdlabs.com
- Vol'nov I.I., Petrocelli A.W. (1966) Klassifikation und Nomenklatur anorganischer Peroxidverbindungen. In: Petrocelli A.W. (Hrsg.) Peroxide, Superoxide und Ozonide von Alkali- und Erdalkalimetallen. Springer, Boston, MA.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.