
Boyle-Mariottes Rechtsgeschichte, Ausdruck, Beispiele
Das Gesetz von Boyle-Mariotte Es ist eines, das die Beziehung zwischen dem von oder auf ein Gas ausgeübten Druck und dem Volumen ausdrückt, das es einnimmt; Halten Sie sowohl die Temperatur des Gases als auch seine Menge (Anzahl der Mol) konstant..
Dieses Gesetz beschreibt zusammen mit dem von Charles, Gay-Lussac, Charles und Avogadro das Verhalten eines idealen Gases; insbesondere in einem geschlossenen Behälter, der Volumenänderungen ausgesetzt ist, die durch eine mechanische Kraft ausgeübt werden.
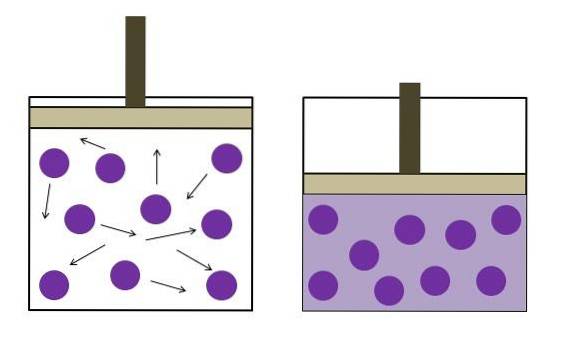
Das Bild oben fasst das Boyle-Mariotte-Gesetz kurz zusammen.
Die violetten Punkte stellen Gasmoleküle oder Atome dar, die mit den Innenwänden des Behälters kollidieren (links). Wenn der verfügbare Raum oder das Volumen des von diesem Gas eingenommenen Behälters abnimmt, nehmen die Kollisionen zu, was sich in einem Druckanstieg niederschlägt (rechts)..
Dies zeigt, dass der Druck P und das Volumen V des Gases umgekehrt proportional sind, wenn der Behälter hermetisch geschlossen ist; Andernfalls würde ein höherer Druck einer größeren Ausdehnung des Gefäßes entsprechen.
Wenn ein Graph V gegen P mit den Daten von V und P auf der Y- bzw. X-Achse erstellt würde, würde eine asymptotische Kurve beobachtet. Je niedriger V ist, desto größer ist die Zunahme von P; Das heißt, die Kurve erstreckt sich in Richtung hoher Werte von P auf der X-Achse.
Natürlich bleibt die Temperatur konstant; Wenn jedoch dasselbe Experiment bei unterschiedlichen Temperaturen durchgeführt würde, würden sich die relativen Positionen dieser V / P-Kurven auf der kartesischen Achse ändern. Die Änderung wäre noch deutlicher, wenn sie auf einer dreidimensionalen Achse aufgetragen würde, wobei T auf der Z-Achse konstant wäre..
Artikelverzeichnis
- 1 Geschichte des Boyle'schen Gesetzes
- 1.1 Hintergrund
- 1.2 Quecksilberversuch
- 1.3 Edme Mariotte
- 1.4 Stärkung des Gesetzes
- 2 Was ist das für ein Gesetz??
- 3 Mathematischer Ausdruck
- 4 Wofür ist es? Welche Probleme löst Boyles Gesetz??
- 4.1 Dampfmaschinen
- 4.2 Getränke schlürfen
- 4.3 Atemwege
- 5 Beispiele (Experimente)
- 5.1 Versuch 1
- 5.2 Versuch 2
- 6 Referenzen
Geschichte des Boyle'schen Gesetzes
Hintergrund
Da der Wissenschaftler Galileo Galilei seinen Glauben an die Existenz eines Vakuums zum Ausdruck brachte (1638), begannen die Wissenschaftler, die Eigenschaften von Luft und Teilhohlräumen zu untersuchen.
Der anglo-irische Chemiker Robert Boyle begann 1638 mit der Untersuchung der Eigenschaften von Luft, als er erfuhr, dass der deutsche Ingenieur und Physiker Otto von Guericke eine Luftpumpe gebaut hatte..
Quecksilberversuch
Für seine Untersuchungen des Luftdrucks verwendete Boyle ein Glasrohr in J-Form, dessen Konstruktion Robert Hooke, einem Assistenten von Boyle, zugeschrieben wurde. Das Ende des kurzen Arms war versiegelt, während das Ende des langen Armes der Röhre offen war, um das Quecksilber zu platzieren.
Boyle wollte von Anfang an die Elastizität von Luft qualitativ und quantitativ untersuchen. Durch Gießen von Quecksilber durch das offene Ende des "J" -Röhrchens folgerte Boyle, dass sich die Luft im kurzen Arm des Rohrs unter dem Druck des Quecksilbers zusammenzog..
Ergebnisse
Je mehr Quecksilber dem Rohr zugesetzt wird, desto größer ist der auf die Luft ausgeübte Druck und desto kleiner ist sein Volumen. Boyle erhielt ein negatives Exponentialdiagramm des Luftvolumens als Funktion des Drucks.
Wenn das Luftvolumen gegen die Umkehrung des Drucks aufgetragen wird, haben wir eine gerade Linie mit einer positiven Steigung.
1662 veröffentlichte Boyle das erste physikalische Gesetz, das in Form einer Gleichung angegeben wurde, die die funktionale Abhängigkeit zweier Variablen anzeigt. In diesem Fall der Druck und das Volumen.
Boyle wies darauf hin, dass es eine umgekehrte Beziehung zwischen dem auf ein Gas ausgeübten Druck und dem Volumen gibt, das das Gas einnimmt, wobei diese Beziehung für reale Gase relativ wahr ist. Die meisten Gase verhalten sich bei moderaten Temperaturen und Drücken wie ideale Gase.
Mit zunehmendem Druck und niedrigeren Temperaturen wurden Abweichungen im Verhalten realer Gase von den Idealen deutlicher.
Edme Mariotte
Die französische Physikerin Edme Mariotte (1620-1684) entdeckte 1679 unabhängig voneinander dasselbe Gesetz. Es hatte jedoch den Vorteil zu zeigen, dass das Volumen mit der Temperatur variiert. Deshalb heißt es Mariotte's Law oder Boyle and Mariotte's Law..
Stärkung des Gesetzes
Daniel Bernoulli (1737) stärkte das Boyle'sche Gesetz, indem er darauf hinwies, dass der Druck eines Gases durch den Aufprall von Gaspartikeln auf die Wände des Behälters erzeugt wird, in dem es sich befindet..
1845 veröffentlichte John Waterston einen wissenschaftlichen Artikel, in dem er sich auf die Hauptprinzipien der kinetischen Theorie der Gase konzentrierte..
Später konsolidierten Rudolf Clausius, James Maxwell und Ludqwig Boltzmann die kinetische Theorie der Gase, die den von einem Gas ausgeübten Druck mit der Geschwindigkeit der bewegten Gaspartikel in Beziehung setzt..
Je kleiner das Volumen des Behälters ist, der ein Gas enthält, desto häufiger treten die Partikel, die es bilden, gegen die Wände des Behälters auf. und daher ist der vom Gas ausgeübte Druck umso größer.
Was ist das für ein Gesetz??
Die von Boyle durchgeführten Experimente zeigen, dass es eine umgekehrte Beziehung zwischen dem von einem Gas eingenommenen Volumen und dem auf es ausgeübten Druck gibt. Die angegebene Beziehung ist jedoch nicht vollständig linear, wie durch ein Diagramm der Variation des Volumens als Funktion des Boyle zugeschriebenen Drucks angezeigt.
Das Boyle'sche Gesetz besagt, dass das von einem Gas eingenommene Volumen umgekehrt proportional zum Druck ist. Es wird auch angezeigt, dass das Produkt aus dem Druck eines Gases und seinem Volumen konstant ist.
Mathematischer Ausdruck
Um zum mathematischen Ausdruck des Boyle-Mariotte-Gesetzes zu gelangen, beginnen wir mit:
V ∝ 1 / P.
Wobei anzeigt, dass das von einem Gas eingenommene Volumen umgekehrt proportional zu seinem Druck ist. Es gibt jedoch eine Konstante, die bestimmt, wie umgekehrt proportional diese Beziehung ist.
V = k / P.
Wobei k die Proportionalitätskonstante ist. Auflösen nach k haben wir:
VP = k
Das Produkt aus dem Druck eines Gases und seinem Volumen ist konstant. Dann:
V.1P.1 = k und V.zweiP.zwei = k
Und daraus lässt sich ableiten, dass:
V.1P.1 = V.zweiP.zwei
Letzteres ist der endgültige Ausdruck oder die Gleichung für das Boyle'sche Gesetz.
Wofür ist das? Welche Probleme löst Boyles Gesetz??
Dampfmaschinen

Das Boyle-Mariotte-Gesetz wird beim Betrieb von Dampfmaschinen angewendet. Es ist ein externer Verbrennungsmotor, der die Umwandlung der Wärmeenergie einer Wassermenge in mechanische Energie nutzt.
Das Wasser wird in einem hermetisch abgeschlossenen Kessel erhitzt, und der erzeugte Dampf übt einen Druck gemäß dem Boyle-Mariote-Gesetz aus, der durch Drücken eines Kolbens eine Volumenausdehnung eines Zylinders erzeugt.
Die lineare Bewegung des Kolbens wird durch die Verwendung eines Systems von Pleueln und Kurbeln, die die Räder einer Lokomotive oder den Rotor eines elektrischen Generators antreiben können, in eine Drehbewegung umgewandelt..
Derzeit ist die alternative Dampfmaschine ein wenig gebrauchter Motor, da sie durch den Elektromotor und den Verbrennungsmotor in Transportfahrzeugen verdrängt wurde.
Trinken Sie etwas
Das Saugen eines Erfrischungsgetränks oder Safts aus einer Flasche durch ein Plastikrohr hängt mit dem Boyle-Mariotte-Gesetz zusammen. Wenn Luft mit dem Mund aus dem Schlauch gesaugt wird, nimmt der Druck im Schlauch ab.
Dieser Druckabfall erleichtert die Aufwärtsbewegung der Flüssigkeit im Rohr und ermöglicht deren Aufnahme. Das gleiche Prinzip gilt für die Blutentnahme mit einer Spritze..
Atmungssystem
Das Boyle-Mariotte-Gesetz ist eng mit der Funktionsweise der Atemwege verbunden. Während der Inspirationsphase ziehen sich das Zwerchfell und andere Muskeln zusammen; Zum Beispiel die äußeren Interkostalen, die eine Ausdehnung des Brustkorbs bewirken.
Dies führt zu einer Abnahme des intrapleuralen Drucks, was zu einer Lungenexpansion führt, die zu einer Zunahme des Lungenvolumens führt. Daher sinkt der intrapulmonale Druck nach dem Boyle-Mariotte-Gesetz.
Wenn der intrapulmonale Druck subatmosphärisch wird, strömt atmosphärische Luft in die Lunge, was zu einem Druckanstieg in der Lunge führt. Auf diese Weise wird der Druck dem atmosphärischen Druck gleichgesetzt und die Inspirationsphase abgeschlossen.
Anschließend entspannen sich die Inspirationsmuskeln und die Exspirationsmuskeln ziehen sich zusammen. Darüber hinaus tritt ein elastischer Lungenrückzug auf, ein Phänomen, das zu einer Abnahme des Lungenvolumens und damit zu einem Anstieg des intrapulmonalen Drucks führt, was durch das Boyle-Mariotte-Gesetz erklärt wird..
Wenn der intrapulmonale Druck ansteigt und größer als der atmosphärische Druck wird, strömt Luft von der Innenseite der Lunge in die Atmosphäre. Dies geschieht, bis sich die Drücke ausgleichen, was die Ablaufphase abschließt..
Beispiele (Experimente)
Versuch 1
Ein kleiner hermetisch geschlossener Ballon wird platziert und bildet einen Knoten in seinem Mund in einer Spritze von ungefähr 20 ml, aus der der Kolben herausgezogen wurde. Der Kolben der Spritze wird in Richtung der Mitte der Spritze platziert, die Nadel wird zurückgezogen und der Lufteinlass wird blockiert.
Überwachung
Durch langsames Ziehen des Kolbens des Injektors wird beobachtet, dass sich der Ballon aufbläst.
Erläuterung
Auf die Wand des Ballons werden zwei Drücke ausgeübt: ein Druck auf seine Innenseite, ein Produkt der im Ballon enthaltenen Luft, und ein weiterer Druck auf die Außenseite des Ballons, der durch die in der Spritze enthaltene Luft ausgeübt wird..
Durch Ziehen des Injektorkolbens entsteht im Inneren ein halbes Vakuum. Daher nimmt der Luftdruck an der Außenseite der Pumpenwand ab, wodurch der in der Pumpe ausgeübte Druck relativ höher wird..
Dieser Nettodruck führt nach dem Boyle-Mariote-Gesetz zu einer Dehnung der Wand des Ballons und zu einer Vergrößerung des Ballonvolumens..
Experiment 2
Eine Plastikflasche wird ungefähr in zwei Hälften geschnitten, um sicherzustellen, dass der Schnitt so horizontal wie möglich ist. Ein eng anliegender Ballon wird in den Mund der Flasche gelegt, gleichzeitig wird eine bestimmte Menge Wasser in eine tiefe Platte gegeben.
Überwachung
Durch Platzieren des Flaschenbodens mit dem Ballon über dem Wasser in der Schale wird der Ballon mäßig aufgeblasen.
Erläuterung
Das Wasser verdrängt eine bestimmte Luftmenge und erhöht den Luftdruck an der Flaschenwand und im Inneren des Ballons. Dies führt nach dem Boyle-Mariotte-Gesetz zu einer Zunahme des Ballonvolumens, die durch das Aufblasen des Ballons sichtbar wird..
Verweise
- Wikipedia. (2019). Boyles Gesetz. Wiederhergestellt von: en.wikipedia.org
- Die Herausgeber der Encyclopaedia Britannica. (27. Juli 2018). Boyles Gesetz. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Helmenstine, Todd. (5. Dezember 2018). Die Formel für das Boyle'sche Gesetz. Wiederhergestellt von :oughtco.com
- Junge indische Filme. (15. Mai 2018). Boyles Gesetz: Wissenschaftliches Experiment für Kinder. Wiederhergestellt von: yifindia.com
- Cecilia Bembibre. (22. Mai 2011). Heißluftballon. Definition ABC. Wiederhergestellt von: definicionabc.com
- Ganong, W, F. (2003). Medizinische Physiologie. (19. Ausgabe). Editorial das moderne Handbuch.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.