
Natriumperoxid (Na2O2) Struktur, Eigenschaften, Verwendungen

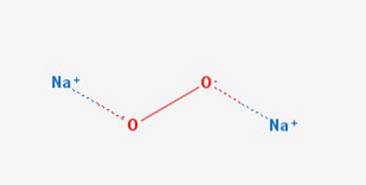
Das Natriumperoxid ist eine chemische Verbindung der Formel NazweiODERzwei Es hat zwei Ionenbindungen zwischen den beiden Natriumatomen und dem O2-Molekül. Es kommt in verschiedenen Hydraten und Peroxyhydraten einschließlich Na vorzweiODERzwei 2HzweiODERzwei 4HzweiAuf einenzweiODERzwei 2HzweiAuf einenzweiODERzwei 2HzweiODERzwei und NazweiODERzwei 8HzweiODER.
Es hat eine hexagonale Kristallstruktur. Beim Erhitzen geht diese Form jedoch bei 512 ° C in eine Phase unbekannter Symmetrie über. Die Kristallstruktur ist in Abbildung 2 dargestellt (Natrium: Natriumperoxid, 1993-2016)..

Natriumperoxid kann in großem Maßstab hergestellt werden, indem metallisches Natrium mit Sauerstoff bei 130-200 ° C umgesetzt wird (Ashford, 1994), ein Prozess, bei dem Natriumoxid erzeugt wird, das in einer separaten Stufe Sauerstoff absorbiert:
4 Na + O.zwei → NazweiODER
2 NazweiO + O.zwei → 2 NazweiODERzwei
Das vorliegende Chargenverfahren beinhaltet die Oxidation von Natrium in Natriummonoxid mit trockener Luft und die anschließende Oxidation des Monoxids in Peroxid mit 90% Sauerstoff..
1951 begann USI mit dem Betrieb des ersten kontinuierlichen Verfahrens zur Herstellung von Natriumperoxid. Der Prozess ist in einer Hinsicht einzigartig: Er verwendet Luft anstelle von reinem Sauerstoff.
Variationen eines Batch-Verfahrens werden seit fast 70 Jahren verwendet (SCHOW, 1957), beispielsweise enthält das Handelsprodukt zwischen 90 und 95% Wasserstoffperoxid.
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Natriumperoxid
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften von Natriumperoxid
Natriumperoxid ist ein gelblicher körniger Feststoff, der bei Kontakt mit der Atmosphäre gelb wird (Nationales Zentrum für Biotechnologie-Informationen, S.F.). Ihr Aussehen ist in Abbildung 3 dargestellt.

Natriumperoxid hat ein Molekulargewicht von 77,98 g / mol und eine Dichte von 2,805 g / ml. Die Verbindung hat einen Schmelzpunkt von 460,00 ° C, wo sie sich gemäß der Reaktion zu Natriumoxid und molekularem Sauerstoff zu zersetzen beginnt:
2 Na 2 O 2 → 2 Na 2 O + O 2
Sein Siedepunkt beträgt 657 ° C (Royal Society of Chemistry, 2015).
Natriumperoxid reagiert heftig mit Reduktionsmitteln, brennbaren Materialien und Leichtmetallen. Reagiert exotherm und schnell oder sogar explosionsartig mit Wasser unter Bildung einer starken Base (NaOH) und Sauerstoff (O2).
Ein Gemisch mit Ammoniumpersulfat kann explodieren, wenn es Reibung ausgesetzt wird (Mahlen in einem Mörser), wenn es erhitzt wird oder wenn ein Kohlendioxidgasstrom darüber geleitet wird..
Reagiert sehr heftig mit Schwefelwasserstoffgas. Selbst in Abwesenheit von Luft kann die Reaktion von einer Flamme begleitet werden. Eine Explosion tritt auf, wenn Kohlendioxidgas über ein Gemisch aus Natriumperoxid und Magnesiumpulver geleitet wird..
Gemische mit Essigsäure oder Essigsäureanhydrid können explodieren, wenn sie nicht kalt gehalten werden. Sie sind bei Kontakt mit Anilin, Benzol, Diethylether oder organischen Materialien wie Papier und Holz spontan entflammbar..
Mischungen mit Holzkohle, Glycerin, bestimmten Ölen und Phosphor verbrennen oder explodieren. Eine Mischung mit Calciumcarbid (Pulver) kann an feuchter Luft in Flammen aufgehen und beim Erhitzen explodieren.
Es zersetzt sich häufig heftig in Gegenwart katalytischer Mengen Mangandioxid. Die Mischung mit Schwefelmonochlorid führt zu einer heftigen Reaktion. Es kann reagieren und die Entzündung von Kraftstoffen verursachen (Natriumperoxid, 2016).
Reaktivität und Gefahren
Natriumperoxid ist eine Verbindung, die aufgrund ihres Reaktivitätsalarms als starkes basisches, explosives und starkes Oxidationsmittel eingestuft wird. Gemische mit brennbarem Material können durch Reibung, Hitze oder Kontakt mit Feuchtigkeit leicht entzündet werden.
Kann sich bei längerer Hitzeeinwirkung kräftig zersetzen und dazu führen, dass Behälter, in denen es enthalten ist, brechen.
Sehr gefährlich bei Kontakt mit Haut und Augen (reizend) sowie bei Verschlucken und Einatmen. Eine längere Exposition kann zu Hautverbrennungen und Geschwüren führen. Eine Überbelichtung durch Einatmen kann zu Reizungen der Atemwege führen..
Eine Entzündung des Auges ist durch Rötung, Bewässerung und Juckreiz gekennzeichnet. Eine Entzündung der Haut ist durch Juckreiz, Peeling, Rötung oder gelegentliche Blasenbildung gekennzeichnet.
Bei Augenkontakt sollten Sie prüfen, ob Sie Kontaktlinsen tragen, und diese entfernen. Die Augen sollten sofort mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten..
Bei Hautkontakt wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen. Kaltes Wasser kann verwendet werden. Gereizte Haut sollte mit einem Weichmacher bedeckt werden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen..
Evakuieren Sie das Opfer so schnell wie möglich in einen sicheren Bereich. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte. Wenn das Atmen schwierig ist, geben Sie Sauerstoff. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch.
Bei Verschlucken sollte kein Erbrechen ausgelöst werden. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch.
In allen Fällen sofort einen Arzt aufsuchen (Sicherheitsdatenblatt Natriumperoxid, 2013).
Anwendungen
Natriumperoxid wird in Bleichmitteln für Kleidung verwendet, da es mit Wasser unter Bildung von Wasserstoffperoxid reagiert, einem Bleichmittel gemäß der Reaktion:
N / AzweiODERzwei + 2 hzweiO → 2 NaOH + H.zweiODERzwei
Neben Wasserstoffperoxid entsteht bei der Reaktion Natriumhydroxid (Lauge), das die Lösung alkalisch hält. Heißes Wasser und eine alkalische Lösung sind beide notwendig, damit Wasserstoffperoxid am besten als Bleichmittel wirkt (Field, S.F.).
Natriumperoxid wird zum Bleichen von Zellstoff zur Herstellung von Papier und Textilien verwendet. Es wird derzeit hauptsächlich für spezialisierte Laborarbeiten verwendet, beispielsweise für die Mineralgewinnung. Zusätzlich wird Natriumperoxid als Oxidationsmittel bei chemischen Reaktionen verwendet..
Es wird auch als Sauerstoffquelle verwendet, indem es mit Kohlendioxid unter Bildung von Sauerstoff und Natriumcarbonat umgesetzt wird. Daher ist es besonders nützlich bei Tauchausrüstung, U-Booten usw. (Verwendung von Natriumperoxid zur Reinigung der Kohlendioxidemissionen, 2014).
Verweise
- Ashford, R. (1994). Ashfords Wörterbuch der Industriechemikalien. London: Publications Ltd..
- Field, S. (S.F.). Zutaten - Natriumperoxid. Von sci-toys.com abgerufen.
- Sicherheitsdatenblatt Natriumperoxid. (2013, 21. Mai). Von sciencelab.com abgerufen.
- Nationales Zentrum für Informationen zur Biotechnologie. (S.F.). PubChem Compound Database; CID = 14803. Von PubChem abgerufen.
- Royal Society of Chemistry. (2015). Natriumperoxid. Von chemspider.com abgerufen.
- SCHOW, H. R. (1957). Die Geschichte der Natriumperoxidproduktion. Advances in Chemistry, Vol. 19, 118-123.
- Natriumperoxid. (2016). Aus Cameochemikalien gewonnen.
- Natrium: Natriumperoxid. (1993-2016). Aus Webelements abgerufen.
- Verwendung von Natriumperoxid zum Waschen der Kohlendioxidemissionen. (2014, 10. November). Vom Stapelaustausch abgerufen.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.