
Pauling-Skala Elektronegativität und Energiedifferenz

Das Pauling-Skala ist eine willkürliche Skala, die in der Chemie verwendet wird, um das auszudrücken Elektronegativität der Elemente. Dies ist definiert als die Tendenz eines bestimmten Atoms, Elektronen anzuziehen, wenn es mit einem anderen Atom kombiniert wird.
In diesem Sinne neigen Elemente mit hoher Elektronegativität dazu, leicht Elektronen zu gewinnen. Dies sind die Nichtmetalle, während es für ihrerseits weniger elektronegative Elemente wie Metalle einfacher ist, Elektronen abzugeben.
Wenn man die Elektronegativität eines Elements kennt, hat man eine Vorstellung von der Art der Bindung, die es bilden kann, wenn es mit einem anderen kombiniert wird. Wir werden dies später anhand eines numerischen Beispiels sehen..
Mit diesen Informationen können viele der Eigenschaften einer Verbindung vorhergesagt werden, was in der experimentellen Chemie und in der Materialwissenschaft, wo ständig neue Verbindungen hergestellt werden, sehr nützlich ist..
Es ist jedoch zweckmäßig zu klären, dass es trotz seiner Wichtigkeit keinen einzigen Weg gibt, die Elektronegativität zu bestimmen. Die Pauling-Skala ist nur eine der verschiedenen vorgeschlagenen Methoden, um sie zu finden, obwohl sie eine der am häufigsten verwendeten ist.
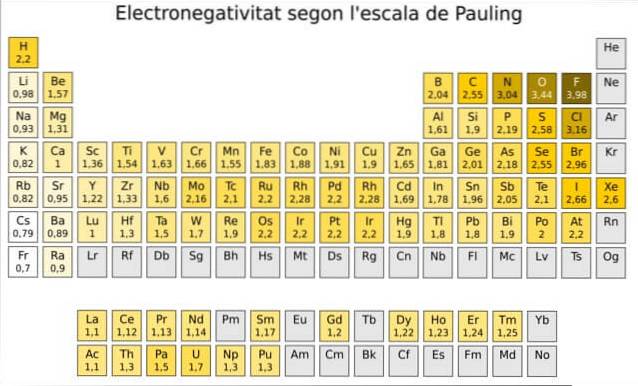
Tatsächlich ist Pauling eine beliebige Skala, in der jedem Element im Periodensystem ein numerischer Wert zugewiesen wird, der seine Elektronegativität widerspiegelt. Wir sehen es in Abbildung 1, wo wir die Elektronegativität jedes Elements haben, wie sie vom zweifachen Nobelpreisträger Linus Pauling (1901-1994) um 1939 zugewiesen wurde.
Artikelverzeichnis
- 1 Die Elektronegativität der Elemente
- 1.1 Elektronegativität im Periodensystem
- 2 Bindungsenergiedifferenz
- 2.1 Gleichungen für die Elektronegativität
- 3 Beispiel
- 3.1 Lösung
- 4 Referenzen
Die Elektronegativität der Elemente
Pauling fand zusammen mit Don M. Yost die Elektronegativitätswerte empirisch anhand experimenteller Daten, die durch Messung der Bindungsenergien erhalten wurden..
Pauling wies dem Element Fluor - über und rechts von der Tabelle in Abbildung 1 - die höchste Elektronegativität mit der Nummer 4.0 zu. Wenn Fluor Bindungen bildet, zeigt es die höchste Tendenz, Elektronen aller Elemente anzuziehen..
Zweitens ist Sauerstoff mit 3,5 und drittens ist Stickstoff mit 3,0. Beide befinden sich oben und rechts neben dem Tisch.
Andererseits ist das am wenigsten elektronegative Element im entgegengesetzten Extrem Cäsium, dessen Symbol Cs ist, das sich links von der Tabelle befindet und dem Pauling die Zahl 0,7 zugewiesen hat.
Elektronegativität im Periodensystem
Im Allgemeinen und wie in Abbildung 1 zu sehen ist, nehmen die Elektronegativität und die Ionisierungsenergie im Periodensystem von links nach rechts zu. Der allgemeine Trend zeigt auch einen Rückgang bei der Bewegung von oben nach unten.
Daher haben wir die elektronegativsten Elemente in der oberen rechten Ecke der Tabelle: Fluor, Sauerstoff, Chlor, Stickstoff. Das am wenigsten elektronegative - oder das elektropositivste, wenn Sie es vorziehen - befindet sich links: Lithium, Natrium, Kalium und die anderen Elemente der Gruppe 1 - die Säule ganz links, die den Alkali- und Erdalkalimetallen entspricht.-.
In jeder Spalte nimmt die Elektronegativität mit zunehmender Ordnungszahl des Elements ab, mit Ausnahme der Übergangsmetalle im Zentrum, die diesem Trend nicht folgen..
Ein wichtiger Punkt ist, dass die Elektronegativität relativ ist, nicht eine unveränderliche Eigenschaft jedes Elements ist und nur in Bezug auf die anderer Elemente gemessen wird. Es hängt stark von der Oxidationsstufe ab, so dass dasselbe Element je nach Art der gebildeten Verbindung eine unterschiedliche Elektronegativität aufweisen kann..
Bindungsenergiedifferenz

In der Chemie ist eine Bindung die Art und Weise, wie sich gleiche oder unterschiedliche Atome zu Molekülen verbinden. Zwischen den Atomen erscheinen Kräfte, die sie stabil zusammenhalten.
Es gibt verschiedene Arten von Links, aber hier werden zwei betrachtet:
-Kovalent, bei dem Atome mit ähnlichen Elektronegativitäten ein Elektronenpaar teilen.
-Ionisch, häufig zwischen Atomen mit unterschiedlichen Elektronegativitäten, bei denen elektrostatische Anziehung vorherrscht.
Angenommen, zwei Elemente A und B können miteinander Moleküle bilden, die mit AA und BB bezeichnet werden. Und dass sie auch in der Lage sind, sich durch irgendeine Art von Bindung zu einer AB-Verbindung zu verbinden.
Dank der Beteiligung intermolekularer Kräfte befindet sich Energie in der Bindung. Zum Beispiel ist die Energie in der Bindung AA E.AA, in Anleihe BB ist es EBB und in Verbindung AB ist es E.AB.
Wenn das Molekül AB durch eine kovalente Bindung gebildet wurde, ist theoretisch die Bindungsenergie der Durchschnitt der Energien E.AA und E.BB::
UNDAB = ½ (E.AA + UNDBB)
Pauling berechnete E.AB für verschiedene Verbindungen maß er es experimentell und bestimmte die Differenz zwischen beiden Werten, die er Δ nannte:
Δ = | (E.AB) gemessen - (E.AB) theoretisch | = | (E.AB) gemessen - ½ (E.AA + UNDBB) |
Pauling argumentierte folgendermaßen: Wenn Δ sehr nahe bei 0 liegt, bedeutet dies, dass die Elektronegativitäten beider Elemente ähnlich sind und die Bindung, die sie verbindet, kovalent ist. Wenn jedoch Δ nicht klein ist, ist die Bindung zwischen A und B nicht rein kovalent.
Je größer der Absolutwert von Δ ist, desto größer ist der Unterschied zwischen der Elektronegativität der Elemente A und B, und daher ist die Bindung, die sie verbindet, vom ionischen Typ. Später wird der Leser ein Beispiel finden, in dem es durch Berechnung von Δ möglich ist, die Art der Bindung einer Verbindung zu bestimmen.
Gleichungen für die Elektronegativität
Unter der Annahme, dass der Unterschied in den Energien das Signal ist, das die Art der Bindung unterscheidet, führte Pauling viele Experimente durch, die ihn dazu veranlassten, einen empirischen Ausdruck für die relativen Elektronegativitäten zweier Elemente A und B zu erstellen, die ein Molekül bilden..
Pauling bezeichnete diese Elektronegativität als χ (griechischer Buchstabe „Chi“) und definierte Δ wie folgt:
F.zwei· Δ = [χ (A) - χ (B)]zwei
χ (A) - χ (B) = f√Δ = 0,102√Δ
Es ist zu beachten, dass Δ eine positive Größe ist. Der Faktor f = 0,102, der durch Multiplikation der Quadratwurzel von Δ auftritt, ist der Umrechnungsfaktor zwischen kJ (Kilojoule) und eV (Elektronenvolt), beide Energieeinheiten.
Wenn stattdessen Kilokalorien und Elektronenvolt verwendet werden, wird der Unterschied in den Elektronegativitäten mit einer ähnlichen Formel ausgedrückt, jedoch mit f = 0,208:
χ (A) - χ (B) = 0,208 Δ
Pauling begann damit, Wasserstoff einen Wert von 2,1 zuzuweisen, einen früheren Wert, den der Chemiker Robert Mulliken erhalten hatte. Er wählte dieses Element als Ausgangspunkt, weil es mit vielen anderen kovalente Bindungen eingeht..
Unter Verwendung der obigen Gleichung wies er den übrigen Elementen weiterhin relative Werte zu. Er erkannte somit, dass die Elektronegativität zunimmt, wenn sie sich im Periodensystem von links nach rechts und von oben nach unten bewegt, wie im vorherigen Abschnitt beschrieben..
Beispiel
Nachfolgend finden Sie eine Liste der Elemente: N, J, Y und M und ihre jeweiligen Elektronegativitäten Χ gemäß der Pauling-Skala:
-N.: Χ = 4,0
-J.: Χ = 1,5
-Y.: Χ = 0,9
-M.: Χ = 1,6
Unter den folgenden mit ihnen gebildeten Verbindungen:
YJ, YN, MN und JM
Geben Sie diejenige mit dem höchsten ionischen Charakter und diejenige an, deren Natur kovalent ist. Grund für Ihre Antwort.
Lösung
Nach den von Pauling festgelegten Kriterien ist die Verbindung mit dem größten ionischen Charakter diejenige mit dem größten Unterschied zwischen den Elektronegativitäten und daher einem größeren Wert von Δ. Die Verbindung mit der geringsten Energiedifferenz ist diejenige mit einer kovalenten Bindung.
Dann berechnen wir wie folgt, wie viel Δ für jede Verbindung wert ist:
Zusammengesetztes YJ
Δ = [χ (Y) - χ (J)]zwei = (0,9 - 1,5)zwei = 0,36
Zusammengesetztes YN
Δ = [χ (Y) - χ (N)]zwei = (0,9 - 4,0)zwei = 9,61
Composite MN
Δ = [χ (M) - χ (N)]zwei = (1,6 - 4,0)zwei = 5,76
Zusammengesetztes JM
Δ = [χ (J) - χ (M)]zwei = (1,5 - 1,6)zwei = 0,01
Aus den vorhergehenden Ergebnissen folgt, dass die ionische Verbindung YN ist, deren Δ = 9,61 ist, während die kovalente Verbindung JM ist, mit Δ = 0,01.
Verweise
- Chemie-Libretexte. Pauling Elektronegativität. Wiederhergestellt von: chem.libretexts.org.
- IUPAC Goldbuch. Elektronegativität. Wiederhergestellt von: goldbook.iupac.org.
- Salas-Banuet, G. Die missverstandene Elektronegativität. Wiederhergestellt von: scielo.org.
- Wissenschaftliche Texte. Elektronegativität. Wiederhergestellt von: textscientificos.com.
- Whitten, K. 2010. Chemie. 9 .. Ed. Brooks / Cole. Lernen einbinden.
- Wikipedia. Kovalente Bindung. Wiederhergestellt von: es.wikipedia.org.
- Wikipedia. Ionenverbindung. Wiederhergestellt von: es.wikipedia.org.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.