
Struktur, Eigenschaften und Verwendung von Cyclopentan (C5H10)
Das Cyclopentan Es ist ein cyclischer Kohlenwasserstoff, insbesondere ein Cycloalkan. Es ist wiederum eine organische Verbindung, deren Summenformel C ist5H.10. Es kann als geschlossene Version des angesehen werden n-Pentan, offene Kette, an deren Enden sich zwei Wasserstoffatome verloren haben.
Das untere Bild zeigt das Gerüst von Cyclopentan. Beachten Sie, wie geometrisch das Skelett aussieht und einen fünfeckigen Ring bildet. Seine Molekülstruktur ist jedoch nicht flach, sondern weist Falten auf, die die Spannung im Ring stabilisieren und reduzieren sollen. Cyclopentan ist eine leicht flüchtige und brennbare Flüssigkeit, jedoch nicht so brennbar wie n-Pentan.
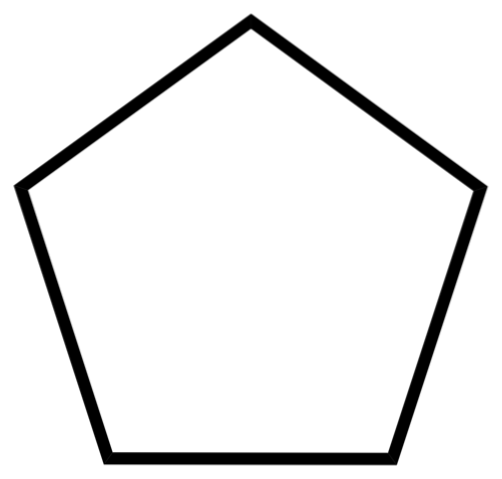
Cyclopentan ist aufgrund seiner Lösungsmittelkapazität eines der am häufigsten verwendeten Lösungsmittel in der chemischen Industrie. Es ist nicht überraschend, dass viele Produkte mit starken Gerüchen es in ihrer Zusammensetzung enthalten und daher brennbar sind. Es wird auch als Treibmittel für Polyurethanschäume verwendet, die in Kühlschränken verwendet werden..
Artikelverzeichnis
- 1 Struktur von Cyclipentan
- 1.1 Intermolekulare Wechselwirkungen
- 1.2 Konformationen und Ringspannung
- 2 Eigenschaften von Cyclipentan
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Schmelzpunkt
- 2.4 Siedepunkt
- 2.5 Flammpunkt
- 2.6 Selbstentzündungstemperatur
- 2.7 Verdampfungswärme
- 2.8 Viskosität
- 2.9 Brechungsindex
- 2.10 Dampfdruck
- 2.11 Dichte
- 2.12 Löslichkeit
- 2.13 Octanol / Wasser-Verteilungskoeffizient
- 2.14 Reaktivität
- 3 Verwendungen
- 3.1 Industrielles Lösungsmittel
- 3.2 Ethylenquelle
- 3.3 Isolieren von Polyurethanschäumen
- 4 Referenzen
Struktur von Cyclipentan
Intermolekulare Wechselwirkungen
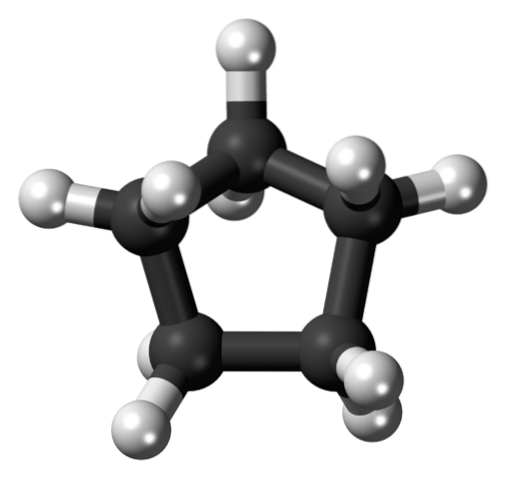
Im ersten Bild wurde das Cyclopentangerüst gezeigt. Oben sehen wir jetzt, dass es mehr als ein einfaches Fünfeck ist: Wasserstoffatome (weiße Kugeln) ragen an seinen Rändern hervor, während Kohlenstoffatome den fünfeckigen Ring (schwarze Kugeln) bilden..
Da sie nur C-C- und C-H-Bindungen aufweisen, ist ihr Dipolmoment vernachlässigbar, sodass Cyclopentanmoleküle nicht durch Dipol-Dipol-Kräfte miteinander interagieren können. Stattdessen werden sie dank der Zerstreuungskräfte Londons zusammengehalten, wobei die Ringe versuchen, sich übereinander zu stapeln..
Diese Stapelung bietet eine Kontaktfläche, die größer ist als die zwischen linearen Molekülen von n-Pentan. Infolgedessen hat Cyclopentan einen höheren Siedepunkt als n-Pentan sowie einen niedrigeren Dampfdruck.
Dispersionskräfte sind dafür verantwortlich, dass Cyclopentan beim Einfrieren bei -94 ºC einen Molekülkristall bildet. Obwohl es nicht viele Informationen über seine Kristallstruktur gibt, ist es polymorph und hat drei Phasen: I, II und III, wobei Phase II eine ungeordnete Mischung von I und III ist.
Konformationen und Ringspannung
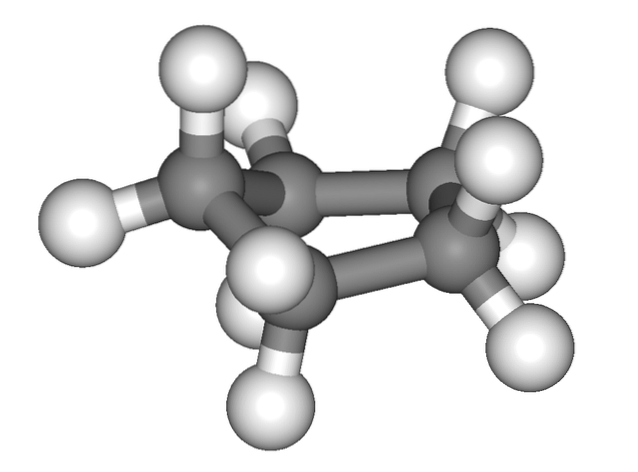
Das obige Bild vermittelt den falschen Eindruck, dass Cyclopentan flach ist. aber so ist es nicht. Alle seine Kohlenstoffatome weisen eine sp-Hybridisierung auf3, Ihre Orbitale befinden sich also nicht in derselben Ebene. Als ob dies nicht genug wäre, sind die Wasserstoffatome sehr nahe beieinander und werden stark abgestoßen, wenn sie verdunkelt werden..
Wir sprechen also von Konformationen, von denen eine der halbe Stuhl ist (oberes Bild). Aus dieser Perspektive ist klar ersichtlich, dass der Cyclopentanring Biegungen aufweist, die dazu beitragen, seine Ringspannung aufgrund seiner so nahe beieinander liegenden Kohlenstoffatome zu verringern..
Diese Spannung ist auf die Tatsache zurückzuführen, dass die C-C-Bindungen Winkel von weniger als 109,5 ° aufweisen, was aufgrund ihrer sp-Hybridisierungen der ideale Wert für die tetraedrische Umgebung ist.3.
Trotz dieses Stresses ist Cyclopentan eine stabilere und weniger brennbare Verbindung als Pentan. Dies kann durch Vergleich ihrer Sicherheitsdiamanten überprüft werden, bei denen die Entflammbarkeit von Cyclopentan 3 und die von Pentan 4 beträgt.
Eigenschaften von Cyclipentan
Aussehen
Farblose Flüssigkeit mit einem milden erdölartigen Geruch.
Molmasse
70,1 g / mol
Schmelzpunkt
-93,9 ºC
Siedepunkt
49,2 ºC
Flammpunkt
-37,2 ºC
Selbstentzündungstemperatur
361 ºC
Verdampfungswärme
28,52 kJ / mol bei 25 ºC
Viskosität
0,413 mPa s
Brechungsindex
1,4065
Dampfdruck
45 kPa bei 20 ° C. Dieser Druck entspricht etwa 440 atm, ist jedoch niedriger als der des n-Pentan: 57,90 kPa.
Hier zeigt sich die Wirkung der Struktur: Der Cyclopentanring ermöglicht effektivere intermolekulare Wechselwirkungen, die im Vergleich zu den linearen Molekülen des Moleküls mehr Moleküle in der Flüssigkeit binden und zurückhalten n-Pentan. Letzterer hat daher einen höheren Dampfdruck.
Dichte
0,751 g / cm3 bei 20 ° C. Andererseits sind seine Dämpfe 2,42-mal dichter als Luft.
Löslichkeit
In einem Liter Wasser bei 25 ° C lösen sich aufgrund seiner hydrophoben Natur nur 156 mg Cyclopentan. Es ist jedoch mit unpolaren Lösungsmitteln wie anderen Paraffinen, Ethern, Benzol, Tetrachlorkohlenstoff, Aceton und Ethanol mischbar..
Octanol / Wasser-Verteilungskoeffizient
3
Reaktivität
Cyclopentan ist bei sachgemäßer Lagerung stabil. Es ist keine reaktive Substanz, da seine C-H- und C-C-Bindungen nicht leicht aufzubrechen sind, obwohl dies zur Freisetzung von Energie führen würde, die durch die Spannung des Rings verursacht wird.
In Gegenwart von Sauerstoff brennt es bei einer Verbrennungsreaktion, sei es vollständig oder unvollständig. Da Cyclopentan eine sehr flüchtige Verbindung ist, muss es an Orten gelagert werden, an denen es keiner Wärmequelle ausgesetzt werden kann..
Währenddessen unterliegt Cyclopentan in Abwesenheit von Sauerstoff einer Pyrolysereaktion, die sich in kleinere und ungesättigte Moleküle zersetzt. Eines davon ist 1-Penten, was zeigt, dass Wärme den Cyclopentanring unter Bildung eines Alkens bricht.
Andererseits kann Cyclopentan unter ultravioletter Strahlung mit Brom reagieren. Auf diese Weise wird eine seiner CH-Bindungen durch C-Br ersetzt, das wiederum durch andere Gruppen ersetzt werden kann; und so entstehen Cyclopentanderivate.
Anwendungen
Industrielles Lösungsmittel
Der hydrophobe und unpolare Charakter von Cyclopentan macht es zusammen mit anderen paraffinischen Lösungsmitteln zu einem entfettenden Lösungsmittel. Aus diesem Grund ist es normalerweise Teil der Formulierungen vieler Produkte wie Klebstoffe, Kunstharze, Farben, Klebstoffe, Tabak und Benzin..
Ethylenquelle
Wenn Cyclopentan einer Pyrolyse unterzogen wird, ist eine der wichtigsten Substanzen, die es erzeugt, Ethylen, das in der Welt der Polymere unzählige Anwendungen findet..
Isolierende Polyurethanschäume
Eine der bemerkenswertesten Verwendungen von Cyclopentan ist als Treibmittel zur Herstellung von isolierenden Polyurethanschäumen; Das heißt, Cyclopentandämpfe dehnen aufgrund ihres hohen Drucks das Polymermaterial aus, bis es einen Schaum mit vorteilhaften Eigenschaften bildet, der im Rahmen von Kühl- oder Gefriergeräten verwendet werden kann.
Einige Unternehmen haben sich entschieden, Cyclopentan bei der Herstellung von Isoliermaterialien durch HFKW zu ersetzen, da dies nicht zur Verschlechterung der Ozonschicht beiträgt und auch die Freisetzung von Treibhausgasen in die Umwelt verringert.
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Wikipedia. (2020). Cyclopentan. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2020). Cyclopentan. PubChem-Datenbank, CID = 9253. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyclopentan. ScienceDirect. Wiederhergestellt von: sciencedirect.com
- GE Appliances. (2011, 11. Januar). Reduzierung der Treibhausgasemissionen in den Kühlanlagen von GE. Wiederhergestellt von: pressroom.geappliances.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.