
Fucosa Eigenschaften, Struktur, Funktionen
Das Fucose (abgekürzt Fuc) oder 6-L-Desoxy-Galactose ist ein teilweise desoxygeniertes (Desoxyzucker) Sechs-Kohlenstoff-Monosaccharid, dessen empirische Formel C lautet6H.12ODER5. Wie andere Monosaccharide ist es ein mehrwertiger Zucker.
Wenn eine Hydroxylgruppe durch ein Wasserstoffatom ersetzt wird, wird ein Desoxyzucker abgeleitet. Obwohl dieser Ersatz theoretisch jede Hydroxylgruppe eines Monosaccharids beeinflussen könnte, gibt es in der Natur nur eine geringe Vielfalt an Desoxyzuckern.
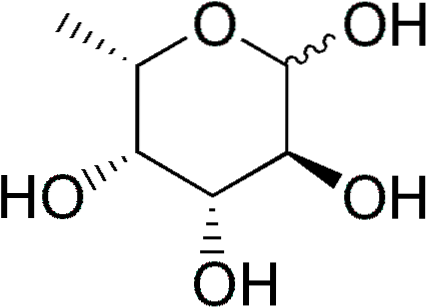
Einige Desoxyzucker sind: 1) Desoxyribose (2-Desoxy-D-Ribose), abgeleitet von D-Ribose, die Teil der DNA ist; 2) Rhamnose (6-D-Desoxymannose), abgeleitet von D-Mannose; 3) Fucose, abgeleitet von L-Galactose. Letzteres ist häufiger als D-Fucose, die von D-Galactose abgeleitet ist.
Artikelverzeichnis
- 1 Eigenschaften und Struktur
- 2 Verbreitung in der Natur
- 3 Fukosestoffwechsel
- 4 Funktionen
- 4.1 Rolle bei Krebs
- 4.2 Rolle bei anderen Krankheiten
- 4.3 Biomedizinisches Potenzial
- 5 Referenzen
Eigenschaften und Struktur
Fucose ist auch unter den Namen 6-Desoxy-Galacto-Hexose, Fucopyranose, Galactomethylose und Rodeose bekannt..
Obwohl normalerweise bei der Bildung von Polysacchariden und Glykoproteinen gefunden, als Monosaccharid isoliert, ist es süßer als Galactose. Dies liegt an der Tatsache, dass der Ersatz einer Hydroxylgruppe durch ein Wasserstoffatom den hydrophoben Charakter und damit die Süße des Moleküls erhöht..
Die Hydroxylgruppen von Fucose können die gleichen Reaktionen wie andere Zucker eingehen und eine Vielzahl von Acetalen, Glycosiden, Ethern und Estern erzeugen..
Ein fucosyliertes Biomolekül ist eines, an das durch die Wirkung einer Fucosyltransferase Fucosemoleküle über glycosidische Bindungen gebunden wurden. Wenn die Hydrolyse von glycosidischen Bindungen durch die Wirkung einer Fucosidase erfolgt, wodurch die Fucose abgetrennt wird, soll das Biomolekül defucosyliert worden sein.
Wenn Glucane fucosyliert werden, werden komplexere Glucane erzeugt, die als Fucane bezeichnet werden und Teil von Glykoproteinen sein können oder nicht. Sulfatierte Fucane sind solche Polysaccharide, die sulfatierte L-Fucose-Reste enthalten. Sie sind typisch für Braunalgen. Beispiele umfassen Ascophylan, Sargasan und Pelvetan..
Einer der am besten untersuchten Fucane ist Fucoidan, das aus Braunalgen gewonnen wird Fucus vesiculosus, das seit Jahrzehnten vermarktet wird (Sigma-Aldrich Chemical Company).
Verbreitung in der Natur
D-Fucose ist in von Mikroben produzierten Antibiotika und in pflanzlichen Glykosiden wie Convolvulin, Chartreusin, Ledienosid und Keirotoxin enthalten.
L-Fucose ist ein Bestandteil von Polysacchariden aus Algen, Pflaumenblättern, Flachs, Soja- und Canola-Samen, Tragantgummi, Kartoffelzellwänden, Maniokknollen, Kiwis, der Rinde der Ceiba und dem Schleim des Maiskaliptra sowie andere Pflanzen.
L-Fucose ist auch in Seeigeleiern und in der Gelatine enthalten, die Froscheier schützt.
Bei Säugetieren bilden Fucane mit L-Fucose die Liganden, die auf die Selectin-vermittelte Leukozyten-Endothel-Adhäsion einwirken und an zahlreichen ontogenetischen Ereignissen teilnehmen.
L-Fucose ist in den Fucosphingolipiden des Magen-Darm-Epithels und des Knochenmarks reichlich vorhanden und kommt in geringen Anteilen in Knorpel- und Keratinstrukturen vor.
Beim Menschen sind L-Fucose-Fucane Teil von Glykoproteinen in Speichel und Magensäften. Sie sind auch Teil der Antigene, die ABO-Blutgruppen definieren. Sie sind in verschiedenen Oligosacchariden in der Muttermilch enthalten.
Fukosestoffwechsel
Fucosyltransferasen verwenden GDP-Fucose, eine Nucleotid-aktivierte Form von Fucose, als Fucosedonor bei der Konstruktion von fucosylierten Oligosacchariden.
GDP-Fucose wird durch aufeinanderfolgende Wirkung von zwei Enzymen aus GDP-Mannose abgeleitet: GDP-Mannose-4,6-Dehydratase und GDP-4-Keto-6-Desoximanose-3,5-Epimerase-4-Reduktase.
Unter Verwendung eines NADP + -Cofaktors katalysiert das erste Enzym die Dehydratisierung von GDP-Mannose. Die Reduktion von Position 6 und die Oxidation von Position 4 erzeugt GDP-6-Desoxy-4-keto-Mannose (während der Reaktion wird der Hybrid von Position 4 auf 6 des Zuckers übertragen).
Das zweite Enzym, das NADPH-abhängig ist, katalysiert die Epimerisierung der Positionen 3 und 5 und die Reduktion der 4-Keto-Gruppe von GDP-6-Desoxy-4-Keto-Mannose..
Bakterien können unter Verwendung von Fucose als einzige Kohlenstoff- und Energiequelle mittels eines durch Fucose induzierbaren Operons wachsen, das katabolische Enzyme für diesen Zucker codiert..
Der obige Prozess beinhaltet: 1) Eintritt von freier Fucose durch die durch eine Permease vermittelte Zellwand; 2) Isomerisierung von Fucose (eine Aldose) unter Bildung von Fuculose (eine Ketose); 3) Phosphorylierung von Fuculose unter Bildung von Fuculose-1-phosphat; 4) eine Aldolase-Reaktion zur Bildung von Lactaldehyd und Dihydroxyacetonphosphat aus Fuculose-1-phosphat.
Eigenschaften
Rolle bei Krebs
Zu den Symptomen vieler Arten von Krebstumoren gehört das Vorhandensein von Glucan-gebundenen Proteinen, die sich durch eine veränderte Oligosaccharidzusammensetzung auszeichnen. Das Vorhandensein dieser abnormalen Glucane, von denen Fucane hervorstechen, hängt mit der Malignität und dem Metastasierungspotential dieser Tumoren zusammen.
Bei Brustkrebs bauen Tumorzellen Fucose in Glykoproteine und Glykolipide ein. Fucose trägt zum Fortschreiten dieses Krebses bei und begünstigt die Aktivierung von Krebsstammzellen, die hämatogene Metastasierung und die Invasion von Tumoren durch extrazelluläre Matrices.
Bei Lungenkarzinomen und Hepatokarzinogenese ist eine erhöhte Fucoseexpression mit einem hohen Metastasierungspotential und einer geringen Überlebenswahrscheinlichkeit verbunden.
Im Gegensatz dazu sind einige sulfatierte Fucane vielversprechende Substanzen bei der Behandlung von Krebs, wie durch zahlreiche In-vitro-Studien mit Krebszelllinien festgestellt wurde, einschließlich solcher, die Brust-, Lungen-, Prostata-, Magen-, Dickdarm- und Rektalkrebs verursachen..
Rolle bei anderen Krankheiten
Eine erhöhte Expression von Fucanen in Serum-Immunglobulinen wurde mit juveniler und adulter rheumatoider Arthritis in Verbindung gebracht.
Leukozytenadhäsionsmangel II ist eine seltene angeborene Krankheit aufgrund von Mutationen, die die Aktivität eines im Golgi-Apparat befindlichen FDP-Fucose-Transporters verändern.
Patienten leiden an geistiger und psychomotorischer Behinderung und an wiederkehrenden bakteriellen Infektionen. Diese Krankheit spricht günstig auf orale Dosen von Fucose an.
Biomedizinisches Potenzial
Aus Braunalgen gewonnene sulfatierte Fucane sind wichtige Reservoire für Verbindungen mit therapeutischem Potenzial.
Sie haben entzündungshemmende und antioxidative Eigenschaften, hemmen die Migration von Lymphozyten an Infektionsstellen und begünstigen die Freisetzung von Zytokinen. Erhöhen Sie die Immunantwort durch Aktivierung von Lymphozyten und Makrophagen.
Sie haben gerinnungshemmende Eigenschaften. Oral gezeigt, dass es die Blutplättchenaggregation bei menschlichen Patienten hemmt.
Sie haben ein antibiotisches und antiparasitäres Potenzial und hemmen das Wachstum von magenpathogenen Bakterien Helicobacter pylori. Töte Parasiten Plasmodium spp. (Erreger der Malaria) und Leishmania donovani (Erreger der amerikanischen viszerotropen Leishmaniose).
Schließlich haben sie starke antivirale Eigenschaften, die den Eintritt mehrerer Viren in die Zelle hemmen, die für die menschliche Gesundheit von großer Bedeutung sind, einschließlich Arenavirus, Cytomegalovirus, Hantavirus, Hepadnavirus, HIV, Herpes-simplex-Virus und Influenzavirus.
Verweise
- Becker, D. J., Lowe, J. B. 2003. Fucose: Biosynthese und biologische Funktion bei Säugetieren. Glycobiology, 13, 41R & ndash; 53R.
- Deniaud-Bouët, E., Hardouin, K., Potin, P., Kloareg, B., Hervé, C. 2017. Ein Überblick über Zellwände von Braunalgen und fucosehaltige sulfatierte Polysaccharide: Zellwandkontext, biomedizinische Eigenschaften und Schlüssel Forschungsherausforderungen Kohlenhydratpolymere, http://dx.doi.org/10.1016/j.carbpol.2017.07.082.
- Flowers H. M. 1981. Chemie und Biochemie von D- und L-Fucose. Fortschritte in der Kohlenhydratchemie und Biochemie, 39, 279-345.
- Listinsky, J.J., Siegal, G.P., Listinsky, C.M. 2011. Die aufkommende Bedeutung von α-L-Fucose bei menschlichem Brustkrebs: eine Übersicht. Am. J. Transl. Res., 3, 292 & ndash; 322.
- Murray, R.K., et al. 2003. Harpers illustrierte Biochemie. McGraw-Hill, New York.
- Pereira, L. 2018. Therapeutische und ernährungsphysiologische Verwendung von Algen. CRC Press, Boca Raton.
- E. Staudacher, F. Altmann, I. B. H. Wilson, L. März 1999. Fucose in N-Glykanen: von der Pflanze zum Menschen. Biochimica et Biophysica Acta, 1473, 216 & ndash; 236.
- Tanner, W., Loewus, F. A. 1981. Pflanzenkohlenhydrate II. Extrazelluläre Kohlenhydrate. Springer, New York.
- Vanhooren, P. T., Vandamme, E. J. 1999. L-Fucose: Vorkommen, physiologische Rolle, chemische, enzymatische und mikrobielle Synthese. Journal of Chemical Technology and Biotechnology, 74, 479 & ndash; 497.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.