
Struktur, Eigenschaften, Verwendungen, Risiken von Natriumnitrat (NaNO3)

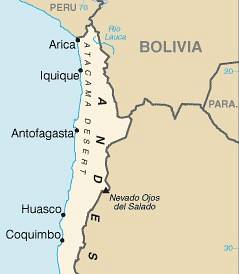
Das Natriumnitrat ist ein kristalliner anorganischer Feststoff, der durch ein Natriumion Na gebildet wird+ und ein Nitration NO3-. Seine chemische Formel lautet NaNO3. In der Natur kommt es als Mineral Nitratin oder Nitratit vor, das in der Atacama-Wüste in Chile im Überfluss vorkommt, weshalb dieses Mineral auch als chilenischer Salpeter oder Caliche bezeichnet wird.
Natriumnitrat ist ein nicht brennbarer Feststoff, kann jedoch die Oxidation oder Verbrennung brennbarer Materialien beschleunigen. Aus diesem Grund wird es häufig in Feuerwerkskörpern, Sprengstoffen, Streichhölzern, Kohleziegeln und einigen Arten von Pestiziden verwendet, um Nagetiere und andere kleine Säugetiere abzutöten..

Die Fähigkeit, die Verbrennung oder Zündung anderer Materialien zu fördern, bedeutet, dass mit großer Vorsicht umgegangen werden muss. Wenn es Flammen oder Feuer ausgesetzt ist, kann es explodieren. Trotzdem die NaNO3 Es wird in der Lebensmittelindustrie verwendet, da es konservierende Eigenschaften hat, insbesondere für Fleisch und einige Käsesorten..
Eine übermäßige Einnahme kann jedoch zu Gesundheitsproblemen führen, insbesondere bei schwangeren Frauen, Babys und Kindern. Durch die Umwandlung in Nitrite im Verdauungssystem kann es zu bestimmten Krankheiten kommen.
Artikelverzeichnis
- 1 Chemische Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Andere Eigenschaften
- 4 Erhalten
- 4.1 Präsenz im menschlichen Körper
- 5 Verwendungen
- 5.1 In der Lebensmittelindustrie
- 5.2 In Düngemitteln
- 5.3 Als Förderer oder Vermittler von Verbrennung oder Explosion
- 5.4 Um Nagetiere und andere Säugetiere zu eliminieren
- 5.5 Bei der Herstellung anderer Verbindungen
- 5.6 Bei der Gewinnung von Metallen aus Elektronikschrott
- 5.7 In der Gesundheits- und Bewegungsforschung
- 5.8 In verschiedenen Anwendungen
- 6 Risiken
- 6.1 Gefahren der Handhabung
- 6.2 Probleme im Zusammenhang mit der Aufnahme von Nahrungsmitteln oder Wasser
- 7 Natriumnitrat in Lebensmitteln
- 8 Referenzen
Chemische Struktur
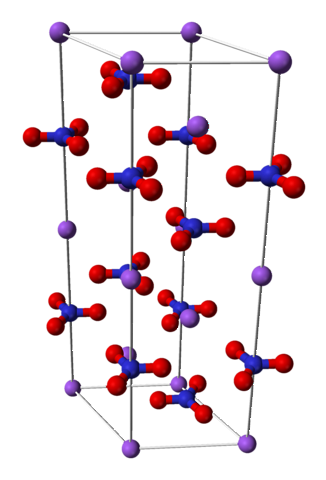
Natriumnitrat besteht aus einem Natriumkation Na+ und ein Nitratanion NO3-.
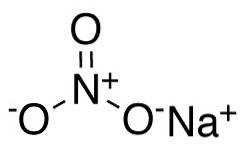
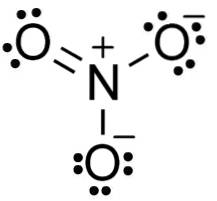
Im Nitratanion NO3- Stickstoff N hat eine Wertigkeit von +5 und Sauerstoff eine Wertigkeit von -2. Aus diesem Grund ist das Nitratanion negativ geladen..
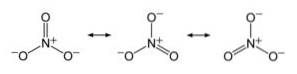
Anion NR3- es hat eine flache und symmetrische Struktur, in der die drei Sauerstoffatome die negative Ladung gleichmäßig oder gleichmäßig verteilen.
Nomenklatur
-Natriumnitrat
-Natriumnitrat
-Natrium-Salpeter (aus dem Englischen Natrium-Salpeter)
-Nitro Soda (aus dem Englischen Soda Nitre)
-Salpeter von Chile
-Nitrat aus Chile
-Nitratin
-Nitratit
-Caliche
Eigenschaften

Körperlicher Status
Farblose bis weiße feste, trigonale oder rhomboedrische Kristalle.
Molekulargewicht
84,995 g / mol
Schmelzpunkt
308 ºC
Siedepunkt
380 ºC (zersetzt sich).
Dichte
2,257 g / cm3 bei 20 ºC.
Löslichkeit
In Wasser löslich: 91,2 g / 100 g Wasser bei 25 ºC oder 1 g in 1,1 ml Wasser. In Ethanol und Methanol schwer löslich.
pH
Natriumnitratlösungen sind neutral, dh weder sauer noch basisch, daher beträgt ihr pH 7.
Andere Eigenschaften
Es ist ein hygroskopischer Feststoff, das heißt, es absorbiert Wasser aus der Umwelt.

Seine Auflösung in Wasser kühlt die Lösung ab, so dass gesagt wird, dass dieser Auflösungsprozess endotherm ist, mit anderen Worten, wenn er sich auflöst, absorbiert er Wärme aus der Umgebung und deshalb kühlt die Lösung ab.
Bei sehr niedrigen Temperaturen ist Natriumnitrat in flüssigem NH-Ammoniak löslich3, Bildung von NaNO34NH3 unter -42 ºC.
Nano3 Es ist nicht brennbar, aber seine Anwesenheit beschleunigt die Verbrennung von Materialien oder Verbindungen, die es sind. Dies liegt daran, dass beim Erhitzen Sauerstoff O entstehtzwei, unter anderen Gasen.
Erhalten
Es wird hauptsächlich durch Gewinnung aus Mineralvorkommen oder Salpeterminen in Chile (Caliche oder Nitratit) gewonnen. Hierzu wird Salzlösung verwendet und anschließend eine Kristallisation und Rekristallisation durchgeführt, um NaNO-Kristalle zu erhalten.3 reiner.
Diese Minen kommen hauptsächlich in Südamerika im Norden Chiles in der Atacama-Wüste vor. Dort ist es mit Kaliumnitrat KNO assoziiert3 und Zersetzung organischer Materie.
Es kann auch durch Umsetzen von Salpetersäure mit Natriumcarbonat Na erhalten werdenzweiCO3 oder mit Natriumhydroxid NaOH:
2 HNO3 + N / AzweiCO3 → 2 NaNO3 + COzwei↑ + H.zweiODER
Präsenz im menschlichen Organismus
Natriumnitrat kann durch Nahrung und Trinkwasser, das es enthält, in den menschlichen Körper gelangen..
60-80% des aufgenommenen Nitrats stammt aus Obst und Gemüse. Eine zweite Quelle ist Wurstwaren. Es wird von der Fleischindustrie verwendet, um das Wachstum von Mikroben zu verhindern und die Farbe zu erhalten.
Ein hoher Anteil an Nitrat im menschlichen Körper stammt jedoch aus seiner endogenen Synthese oder aus Prozessen im Körper..
Anwendungen
In der Lebensmittelindustrie
Es wird als Konservierungsmittel in Lebensmitteln, als Härter für eingelegtes Fleisch und als Farbretentionsmittel für Fleisch verwendet. Lebensmittel, die es enthalten können, sind Speck, Würstchen, Schinken und einige Käsesorten.

In Düngemitteln
Natriumnitrat wird in Düngemittelmischungen zur Düngung von Tabak-, Baumwoll- und Gemüsepflanzen verwendet.

Als Promotor oder Promotor der Verbrennung oder Explosion
Nano3 Es wird in vielen Anwendungen als Oxidationsmittel verwendet. Es ist ein sauerstoffreicher Feststoff, der den Zündvorgang durch die Erzeugung von O erleichtertzwei.
Die Anwesenheit von NaNO3 Materialien benötigen keinen Sauerstoff von externen Quellen, um sich zu entzünden, da sie genügend O liefernzwei in Bezug auf selbsttragende exotherme (wärmeerzeugende) Reaktionen, die während der Zündung oder Explosion auftreten.
Es wird seit langem als Hauptoxidationsmittel in pyrotechnischen Materialien (Feuerwerkskörpern), als oxidierende Komponente in Sprengstoffen und Detonations- oder Strahlmitteln sowie als Treibmittel verwendet.

Es wird auch verwendet, um die Verbrennung von Holzkohleziegeln (Briketts) zu verbessern, die Beleuchtung in Streichhölzern zu begünstigen und sogar die brennbaren Eigenschaften von Tabak zu verbessern..
Um Nagetiere und andere Säugetiere zu eliminieren
Es wird für eine spezielle Art von Pestiziden verwendet. Die Zusammensetzungen, die es enthalten, sind pyrotechnische Begasungsmittel, die in Höhlen platziert und in Brand gesetzt werden und tödliche Dosen giftiger Gase freisetzen.
Aus diesem Grund wird es zur Bekämpfung verschiedener Nagetiere, Murmeltiere, Kojoten und Stinktiere auf offenen Feldern, in Graslandschaften, in unkultivierten Gebieten, auf Rasenflächen und auf Golfplätzen eingesetzt..
Bei der Herstellung anderer Verbindungen
Wird bei der Herstellung von Salpetersäure HNO verwendet3, Natriumnitrit NaNOzwei, und wirkt auch als Katalysator bei der Herstellung von Schwefelsäure H.zweiSW4.
Es wird zur Herstellung von Lachgas N verwendetzweiOder und als Oxidationsmittel bei der Herstellung von pharmazeutischen Verbindungen.
Bei der Gewinnung von Metallen aus Elektroschrott
Bestimmte Forscher fanden, dass NaNO3 erleichtert die umweltfreundliche Gewinnung von Metallen, die in Abfällen elektronischer Geräte (Mobiltelefone, Tablets, Computer usw.) enthalten sind..
Nützliche Metalle, die aus den Komponenten dieser elektronischen Geräte extrahiert werden können, sind Nickel Ni, Cobalt Co, Mangan Mn, Zink Zn, Kupfer Cu und Aluminium Al.
Die Extraktion erfolgt nur mit einer NaNO-Lösung3 und ein Polymer. Und es wird eine Ausbeute von 60% erreicht.
Auf diese Weise können Elektronikschrott recycelt werden, was zur Minimierung von Abfällen und zur stabilen Rückgewinnung von Ressourcen beiträgt..
In der Gesundheits- und Bewegungsforschung
Nach einigen Studien erfolgt die Einnahme von NaNO-Nahrungsergänzungsmitteln3 oder Lebensmittel, die es enthalten, haben natürlich positive Auswirkungen auf die Gesundheit. Einige der nitratreichen Lebensmittel sind Rüben, Spinat und Rucola.
Zu den Effekten gehören die Verbesserung des Herz-Kreislauf-Systems, die Senkung des Blutdrucks, die Verbesserung des Blutflusses und die Erhöhung der Sauerstoffmenge in Geweben, die körperlich trainieren..
Dies weist darauf hin, dass die Verwendung von NaNO in Betracht gezogen werden könnte.3 als kostengünstiges Medikament zur Vorbeugung und Behandlung von Patienten mit Blutdruckproblemen.
Darüber hinaus kann es als wirksame und natürliche Hilfe zur Steigerung der Muskelkraft bei Sportlern dienen.
In verschiedenen Anwendungen

Es wird als Oxidations- und Flussmittel bei der Herstellung von Glas- und Keramikglasuren verwendet. Es wird auch in speziellen Zementen verwendet.
Dient als chemisches Mittel bei der Rückgewinnung von Zinn aus Altmetall, bei der Latexkoagulation, in der Nuklearindustrie und bei der Kontrolle der Korrosion in wässrigen Systemen.
Risiken
Gefahren der Handhabung
Es hat die Eigenschaft, die Verbrennung brennbarer Materialien zu beschleunigen. Wenn Sie in ein Feuer verwickelt sind, kann eine Explosion auftreten.
Wenn es längere Zeit Hitze oder Feuer ausgesetzt wird, kann es explodieren und giftige Stickoxide produzieren..
Probleme im Zusammenhang mit der Aufnahme mit Nahrung oder Wasser
Bei Einnahme kann Nitrat sowohl im Mund als auch im Magen und Darm zu Nitrit werden..
Nitrit kann bei der Reaktion mit den in einigen Lebensmitteln enthaltenen Aminen in einer sauren Umgebung wie dem Magen zu Nitrosaminen werden. Nitrosamine sind krebserregend.
Dies tritt jedoch nicht auf, wenn Obst und Gemüse, die Nitrate enthalten, auf natürliche Weise verzehrt werden..
Nach einigen Studien kann das Vorhandensein hoher Nitratwerte zu einer Bluterkrankung führen, die dazu führt, dass Sauerstoff im Gewebe nicht effektiv freigesetzt werden kann.
Dies kann bei Babys auftreten, deren Milchformel aus nitrathaltigem Brunnenwasser hergestellt wird..
Es wurde auch beobachtet, dass hohe Nitratspiegel Probleme in der Schwangerschaft von Babys verursachen können, die spontane Abtreibungen, Frühgeburten oder Defekte im Neuralrohr des Fötus verursachen.
Kürzlich wurde festgestellt, dass Natriumnitrat ein Risiko für die Entwicklung des Bewegungsapparates darstellen kann und die Kommunikation zwischen Nerven und Muskeln beim Menschen beeinträchtigt wird.
Natriumnitrat in Lebensmitteln

Natriumnitrat ist ein Synonym für Fleisch, da sie zusammen mit Nitrit hinzugefügt werden, um sie zu konservieren und ihr Aussehen und ihren Geschmack zu verbessern. Aus diesem Grund war der übermäßige Verzehr von Fleisch (Hot Dogs, Speck, Schinken, geräucherter Fisch usw.) an der störenden Verbindung von Krebserkrankungen im gesamten Verdauungssystem beteiligt.
Obwohl die Beziehung zwischen mit Nitrat-Nitrit-Salzen behandeltem Fleisch und Krebs nicht absolut ist, wird empfohlen, die Aufnahme zu moderieren.
Gemüse (Karotten, Rüben, Radieschen, Salat, Spinat usw.) ist dagegen reich an NaNO3 da sie es aufgrund seiner Düngungswirkung aus Kulturböden aufgenommen haben. Die Aufnahme dieses Gemüses ist im Gegensatz zu Fleischprodukten nicht mit den oben genannten Krankheiten verbunden.
Dies hat zwei Gründe: den Unterschied in den Proteinspiegeln solcher Lebensmittel und die Art und Weise, wie sie gekocht werden. Wenn Fleisch gebraten oder zur Flamme erhitzt wird, wird die Reaktion zwischen Nitraten-Nitriten mit bestimmten Gruppen von Aminosäuren gefördert, um so Nitrosoamine zu produzieren: die wahren Karzinogene.
Der Gehalt an Vitamin C, Ballaststoffen und Polyphenolen in Gemüse reduziert die Bildung dieser Nitrosoamine. Deshalb NaNO3 allein ist keine Bedrohung für Lebensmittel.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Natriumnitrat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. und Ravanbod, M. (2015). Kinetische Untersuchung von Mg / NaNO3 Pyrotechnik mit nicht-isothermer TG / DSC-Technik. J Therm Anal Calorim (2015) 119: 2281 & ndash; 2288. Von link.springer.com wiederhergestellt.
- Jarosz, J. et al. (2016). Natriumnitrat verringert die Agrin-induzierte Acetylcholinrezeptor-Clusterbildung. BMC Pharmacology and Toxicology (2016) 17:20. Von bmcpharmacoltoxicol.biomedcentral.com wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Prival, M.J. (2003). Krebs. Karzinogene in der Nahrungskette. In der Encyclopedia of Food Sciences and Nutrition (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Zakhodyaeva, Y.A. et al. (2019). Komplexe Extraktion von Metallen in einem wässrigen Zweiphasensystem auf Basis von Poly (ethylenoxid) 1500 und Natriumnitrat. Molecules 2019, 24, 4078. Von mdpi.com wiederhergestellt.
- Clements, W.T. et al. (2014). Nitrataufnahme: Ein Überblick über die Auswirkungen auf Gesundheit und körperliche Leistungsfähigkeit. Nutrients 2014, 6, 5224 & ndash; 5264. Von mdpi.com wiederhergestellt.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.