
Elektrolytische Zellteile, Funktionsweise und Anwendungen
Das Elektrolysezelle Es ist ein Medium, in dem Energie oder elektrischer Strom verwendet wird, um eine nicht spontane Oxidreduktionsreaktion durchzuführen. Es besteht aus zwei Elektroden: der Anode und der Kathode.
An der Anode (+) tritt Oxidation auf, da an dieser Stelle einige Elemente oder Verbindungen Elektronen verlieren; während in der Kathode (-) die Reduktion, da in ihr einige Elemente oder Verbindungen Elektronen gewinnen.
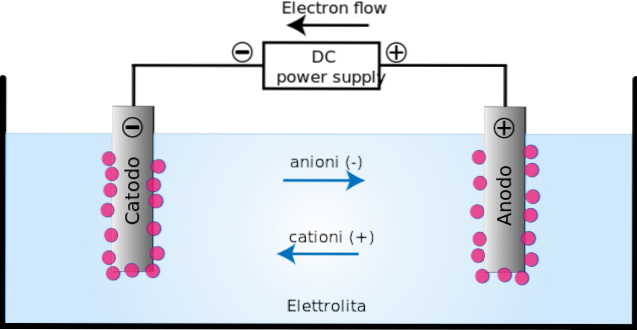
In der Elektrolysezelle erfolgt die Zersetzung einiger zuvor ionisierter Substanzen durch einen als Elektrolyse bekannten Prozess..
Das Anlegen des elektrischen Stroms erzeugt eine Orientierung in der Bewegung der Ionen in der Elektrolysezelle. Positiv geladene Ionen (Kationen) wandern in Richtung der Ladekathode (-).
Währenddessen wandern die negativ geladenen Ionen (Anionen) zur geladenen Anode (+). Diese Ladungsübertragung stellt einen elektrischen Strom dar (oberes Bild). In diesem Fall wird der elektrische Strom durch Elektrolytlösungen geleitet, die im Elektrolysezellenbehälter vorhanden sind..
Das Faradaysche Gesetz der Elektrolyse besagt, dass die Menge an Substanz, die an jeder Elektrode oxidiert oder reduziert wird, direkt proportional zur Menge an Elektrizität ist, die durch die Zelle oder Zelle fließt..
Artikelverzeichnis
- 1 Teile
- 2 Wie funktioniert eine Elektrolysezelle??
- 2.1 Elektrolyse von geschmolzenem Natriumchlorid
- 2.2 Down Cell
- 3 Anwendungen
- 3.1 Industrielle Synthesen
- 3.2 Beschichten und Raffinieren von Metallen
- 4 Referenzen
Teile
Eine Elektrolysezelle besteht aus einem Behälter, in dem sich das Material ablagert, das die durch die elektrische Ladung induzierten Reaktionen durchläuft..
Der Behälter verfügt über ein Elektrodenpaar, das an eine Gleichstrombatterie angeschlossen ist. Die üblicherweise verwendeten Elektroden bestehen aus einem inerten Material, dh sie nehmen nicht an den Reaktionen teil.
Ein Amperemeter kann in Reihe mit der Batterie geschaltet werden, um die Intensität des durch die Elektrolytlösung fließenden Stroms zu messen. Ebenso wird ein Voltmeter parallel geschaltet, um die Spannungsdifferenz zwischen dem Elektrodenpaar zu messen..
Wie funktioniert eine Elektrolysezelle??
Elektrolyse von geschmolzenem Natriumchlorid
Es ist bevorzugt, geschmolzenes Natriumchlorid gegenüber festem Natriumchlorid zu verwenden, da dieses keine Elektrizität leitet. Ionen vibrieren in Ihren Kristallen, aber sie können sich nicht frei bewegen.
Kathodenreaktion
Elektroden aus Graphit, einem inerten Material, werden an die Batterieklemmen angeschlossen. Eine Elektrode ist mit dem Pluspol der Batterie verbunden und bildet die Anode (+)..
Währenddessen ist die andere Elektrode mit dem Minuspol der Batterie verbunden und bildet die Kathode (-). Wenn Strom aus der Batterie fließt, wird Folgendes beobachtet:
An der Kathode (-) findet eine Reduktion des Na-Ions statt+, die beim Gewinn eines Elektrons in metallisches Na umgewandelt werden:
N / A+ + und- => Na (l)
Silberweißes metallisches Natrium schwimmt auf geschmolzenem Natriumchlorid.
Anodenreaktion
Im Gegenteil, die Oxidation des Cl-Ions findet an der Anode (+) statt.-, da es Elektronen verliert und zu Chlorgas wird (Clzwei), ein Prozess, der sich durch das Auftreten eines hellgrünen Gases an der Anode manifestiert. Die an der Anode ablaufende Reaktion kann wie folgt umrissen werden:
2Cl- => Clzwei (g) + 2 e-
Die Bildung von metallischem Na- und Cl-Gaszwei Bei NaCl handelt es sich nicht um einen spontanen Prozess, für dessen Auftreten Temperaturen über 800 ° C erforderlich sind. Der elektrische Strom liefert die Energie, so dass die angegebene Umwandlung an den Elektroden der Elektrolysezelle erfolgt..
Während des Reduktionsprozesses werden Elektronen an der Kathode (-) verbraucht und während der Oxidation an der Anode (+) erzeugt. Daher fließen Elektronen durch den externen Stromkreis der Elektrolysezelle von Anode zu Kathode..
Die Gleichstrombatterie liefert die Energie, damit die Elektronen nicht spontan von der Anode (+) zur Kathode (-) fließen können..
Down Cell
Die Down-Zelle ist eine Adaption der Elektrolysezelle, die für die industrielle Herstellung von metallischem Na- und Chlorgas beschrieben und verwendet wird..
Die Elektrolysezelle von Down verfügt über Vorrichtungen, mit denen metallisches Natrium- und Chlorgas getrennt gesammelt werden kann. Diese Methode zur Herstellung von metallischem Natrium ist immer noch sehr praktisch.
Sobald es durch Elektrolyse freigesetzt ist, wird das flüssige metallische Natrium abgelassen, abgekühlt und in Blöcke geschnitten. Anschließend wird es in einem inerten Medium gelagert, da Natrium bei Kontakt mit Wasser oder Luftsauerstoff explosionsartig reagieren kann..
Chlorgas wird in der Industrie hauptsächlich durch Elektrolyse von Natriumchlorid in einem kostengünstigeren Verfahren als die Herstellung von metallischem Natrium hergestellt.
Anwendungen
Industrielle Synthesen
-In der Industrie werden Elektrolysezellen zur Galvanisierung und Galvanisierung verschiedener Nichteisenmetalle eingesetzt. Fast alle hochreinen Aluminium-, Kupfer-, Zink- und Bleiprodukte werden industriell in Elektrolysezellen hergestellt..
-Wasserstoff wird durch Elektrolyse von Wasser erzeugt. Dieses chemische Verfahren wird auch zur Gewinnung von schwerem Wasser angewendet (D.zweiODER).
-Metalle wie Na, K und Mg werden durch Elektrolyse von geschmolzenen Elektrolyten erhalten. Auch Nichtmetalle wie Fluoride und Chloride werden durch Elektrolyse erhalten. Auch Verbindungen wie NaOH, KOH, NazweiCO3 und KMnO4 werden nach dem gleichen Verfahren synthetisiert.
Beschichten und Raffinieren von Metallen
-Der Prozess des Beschichtens eines minderwertigen Metalls mit einem Metall höherer Qualität ist als Galvanisieren bekannt. Ziel ist es, Korrosion des unteren Metalls zu verhindern und es attraktiver zu machen. Zu diesem Zweck werden beim Galvanisieren elektrolytische Zellen verwendet..
-Unreine Metalle können durch Elektrolyse raffiniert werden. Im Falle von Kupfer werden sehr dünne Metallbleche auf die Kathode gelegt und große Stäbe aus unreinem Kupfer auf der Anode verfeinert.
-Die Verwendung von furnierten Gegenständen ist in der Gesellschaft üblich. Schmuck und Geschirr sind normalerweise versilbert; Gold wird auf Schmuck und elektrischen Kontakten galvanisch abgeschieden. Viele Gegenstände sind zu Dekorationszwecken mit Kupfer bedeckt.
-Autos haben Kotflügel aus Chromstahl und andere Teile. Die Verchromung einer Autostoßstange dauert nur 3 Sekunden, um eine 0,0002 mm dicke glänzende Oberfläche zu erzeugen.
-Schnelle galvanische Abscheidung von Metall erzeugt raue, schwarze Oberflächen. Langsame galvanische Abscheidung erzeugt glatte Oberflächen. Die "Blechdosen" bestehen aus Stahl, der durch Elektrolyse mit Zinn beschichtet ist. Manchmal werden diese Dosen im Bruchteil einer Sekunde mit der Dicke der extrem dünnen Chromschicht verchromt.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Lernen.
- eMedical Prep. (2018). Anwendungen der Elektrolyse. Wiederhergestellt von: emedicalprep.com
- Wikipedia. (2018). Elektrolysezelle. Wiederhergestellt von: en.wikipedia.org
- Prof. Shapley P. (2012). Galvanische und elektrolytische Zellen. Wiederhergestellt von: butane.chem.uiuc.edu
- Bodner Research Web. (s.f.). Elektrolysezellen. Wiederhergestellt von: chemed.chem.purdue.edu



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.