
Struktur, Eigenschaften und Verwendung von Calciumnitrat (Ca (NO3) 2)

Das Calciumnitrat ist ein tertiäres anorganisches Salz, dessen chemische Formel Ca (NO3)zwei. Aus seiner Formel ist bekannt, dass sein Feststoff aus Ca-Ionen bestehtzwei+ und nein3- im Verhältnis 1: 2. Daher ist es eine Verbindung rein ionischer Natur..
Eine seiner Eigenschaften ist sein oxidierender Charakter aufgrund des Nitratanions. Es ist nicht brennbar, dh es brennt nicht bei hohen Temperaturen. Da es nicht brennbar ist, stellt es einen sicheren Feststoff dar, der ohne große Sorgfalt gehandhabt werden kann. es kann jedoch die Zündung brennbarer Materialien beschleunigen.

Sein Aussehen besteht aus einem körnigen Feststoff, der eine weiße oder hellgraue Farbe hat (oberes Bild). Es kann wasserfrei oder Tetrahydrat sein, Ca (NO3)zwei4HzweiO. Es ist sehr gut löslich in Wasser, Methanol und Aceton.
Calciumnitrat wird häufig als Dünger verwendet, da es sich leicht in feuchten Böden fortbewegt und schnell von Pflanzenwurzeln aufgenommen wird. Bietet zwei wichtige Elemente für die Ernährung und das Wachstum von Pflanzen: Stickstoff und Kalzium.
Stickstoff ist eines der drei wesentlichen Elemente für die Entwicklung von Pflanzen (N, P und K), es ist wesentlich für die Synthese von Proteinen. In der Zwischenzeit ist Kalzium notwendig, um die Struktur der Pflanzenzellwand aufrechtzuerhalten. Aus diesem Grund Ca (NO3)zwei viel geht in gärten.
Andererseits hat dieses Salz toxische Wirkungen, insbesondere durch direkten Kontakt mit Haut und Augen sowie durch Einatmen seines Staubes. Zusätzlich kann es durch Erhitzen zersetzt werden.
Artikelverzeichnis
- 1 Struktur von Calciumnitrat
- 2 Physikalische und chemische Eigenschaften
- 2.1 Chemische Namen
- 2.2 Summenformel
- 2.3 Molekulargewicht
- 2.4 Aussehen
- 2,5 Siedepunkt
- 2.6 Schmelzpunkt
- 2.7 Löslichkeit in Wasser
- 2.8 Löslichkeit in organischen Lösungsmitteln
- 2.9 Säure (pKa)
- 2.10 Dichte
- 2.11 Zersetzung
- 2.12 Reaktives Profil
- 3 Verwendungen
- 3.1 Landwirtschaft
- 3.2 Beton
- 3.3 Abwasser- oder Abwasserbehandlung
- 3.4 Kalte Kompressen herstellen
- 3.5 Latexkoagulation
- 3.6 Wärmeübertragung und -speicherung
- 4 Antragsformen
- 5 Referenzen
Struktur von Calciumnitrat
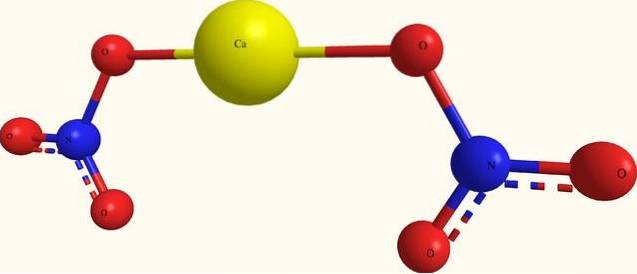
Das obere Bild zeigt die Struktur von Ca (NO3)zwei in einem Modell von Kugeln und Balken. Hier gibt es jedoch einen Fehler: Die Existenz kovalenter Ca-O-Bindungen wird angenommen, was ihrem ionischen Charakter widerspricht. Um dies zu verdeutlichen, sind die Wechselwirkungen tatsächlich vom elektrostatischen Typ.
Das Kation Ca.zwei+ umgibt sich mit zwei NO-Anionen3- nach seinen Proportionen auf dem Glas. Daher überwiegt Stickstoff in Form von Nitrat in der Kristallstruktur..
Die Ionen sind so gruppiert, dass sie eine Konfiguration bilden, deren minimale Expression die Einheitszelle ist; welches für das wasserfreie Salz kubisch ist. Das heißt, aus Würfeln, die das Verhältnis 1: 2 für diese Ionen enthalten, wird der gesamte Kristall reproduziert.
Andererseits ist das Tetrahydratsalz Ca (NO3)zwei4HzweiOder es hat vier Wassermoleküle für jeden Satz NO3- ACzwei+ NICHT3-. Dies modifiziert die Kristallstruktur und verformt sie in eine monokline Einheitszelle..
Daher wird erwartet, dass die Kristalle sowohl für das wasserfreie als auch für das Tetrahydratsalz unterschiedlich sind; Unterschiede, die in ihren physikalischen Eigenschaften bestimmt werden können, zum Beispiel Schmelzpunkte.
Physikalische und chemische Eigenschaften
Chemische Namen
-Calciumnitrat
-Calciumdinitrat
-Nitrocalcit
-Norwegischer Salpeter und Limesaltpetro.
Molekularformel
Tülle3)zwei oder CaNzweiODER6
Molekulargewicht
Wasserfrei 164,088 g / mol und Tetrahydrat 236,15 g / mol. Beachten Sie die Wirkung von Wasser auf das Molekulargewicht und es kann beim Wiegen nicht vernachlässigt werden..
Aussehen
Weißer oder hellgrauer Feststoff oder Granulat. Kubische weiße Kristalle oder zerfließende Körnchen; Das heißt, sie absorbieren Feuchtigkeit bis zu dem Punkt, an dem sie sich aufgrund ihrer hohen Löslichkeit auflösen.
Siedepunkt
Die wasserfreie Form zersetzt sich beim Erhitzen auf eine Temperatur, die die Bestimmung ihres Siedepunktes verhindert; während die Tetrahydratform des Salzes einen Siedepunkt von 132ºC (270ºF, 405K) hat.
Schmelzpunkt
-Wasserfreie Form: 561 ° C bis 760 mmHg (1042 ° F, 834 K).
-Tetrahydratform: 42,7 ° C (109 ° F, 316 K).
Dies zeigt, wie Wassermoleküle die elektrostatischen Wechselwirkungen zwischen Ca störenzwei+ und nein3- in den Kristallen; und folglich schmilzt der Feststoff bei einer viel niedrigeren Temperatur.
Wasserlöslichkeit
-Wasserfreie Form: 1212 g / l bei 20 ºC.
-Tetrahydratform: 1290 g / l bei 20 ºC.
Das Wasser in den Kristallen erhöht die Löslichkeit des Salzes kaum.
Löslichkeit in organischen Lösungsmitteln
-In Ethanol 51,42 g / 100 g bei 20 ° C..
-In Methanol 134 g / 100 g bei 10 ° C..
-In Aceton 168 g / 100 g bei 20 ° C..
Säure (pKa)
6.0
Dichte
2,5 g / cm3 bei 25 ºC (Tetrahydrat).
Zersetzung
Wenn Calciumnitrat zur Glühbirne erhitzt wird, zersetzt es sich in Calciumoxid, Stickoxid und Sauerstoff..
Reaktives Profil
Es ist ein stark oxidierendes Mittel, aber es ist nicht brennbar. Beschleunigt die Zündung brennbarer Materialien. Die Aufteilung von Calciumnitrat in feine Partikel erleichtert die Explosion, wenn die Verbindung längerem Feuer ausgesetzt ist.
Gemische mit Alkylestern werden durch die Entstehung von Alkylnitratestern explosiv. Die Kombination von Calciumnitrat mit Phosphor, Zinn (II) -chlorid oder einem anderen Reduktionsmittel kann explosionsartig reagieren.
Anwendungen
Landwirtschaft
Es wird in Kulturpflanzen als Stickstoff- und Kalziumquelle verwendet. Calciumnitrat ist in Wasser sehr gut löslich und wird von Pflanzenwurzeln leicht aufgenommen. Darüber hinaus säuert es Böden nicht an, da seine Ionen nicht signifikant hydrolysiert werden können..
Das Mischen mit Düngemitteln, die Phosphor oder Sulfat enthalten, sollte vermieden werden, um die Bildung unlöslicher Salze zu vermeiden. Aufgrund seiner Hygroskopizität sollte es in einer trockenen und kühlen Umgebung gelagert werden.
Seine Verwendung hat einen Vorteil gegenüber der Verwendung von Ammoniumnitrat als Dünger. Obwohl diese letzte Verbindung Stickstoff zu Pflanzen beiträgt, stört sie die Calciumabsorption, was zu einem Calciummangel in Pflanzen führen kann..
Calcium trägt zur Aufrechterhaltung der Zellwandstruktur von Pflanzen bei. Bei Vorhandensein eines Kalziummangels zeigen die wachsenden Gewebe von Pflanzen wie Wurzelspitzen, junge Blätter und Sprossspitzen häufig ein verzerrtes Wachstum..
Vermindertes Ammoniak
Calciumnitrat reduziert die Anreicherung von flüchtigen Fettsäuren und Phenolverbindungen, die phytotoxisch sind und sich aufgrund der Zersetzung von Sojabohnenresten ansammeln.
Darüber hinaus besteht die Tendenz, dass Calciumnitrat die Ammoniumkonzentration im Boden verringert, was die Wasserstoffpufferkapazität erhöht..
Beton
Calciumnitrat wird verwendet, um die Abbindezeit von Beton zu verkürzen. Dies wird durch die Erzeugung von Calciumhydroxid erzeugt, möglicherweise durch eine Doppelverdrängungsreaktion..
Darüber hinaus induziert Calciumnitrat die Bildung der Eisenhydroxidverbindung, deren Schutzwirkung auf Beton die Korrosion verringert. Das heißt, das vorhandene Eisen kann mit den Grundbestandteilen von Beton wie Calciumhydroxid selbst reagieren..
Calciumnitrat verringert die Abbindezeit sowie die Beständigkeit des Betons, dem Vulkanasche zugesetzt wurde. Um die Wirkung der Zugabe von Calciumnitrat zu Beton zu untersuchen, wurden steigende Konzentrationen von Calciumnitrat zwischen 2% und 10% verwendet..
Es wurde eine stärkere Verkürzung der Abbindezeit sowie eine Zunahme der Betonfestigkeit beobachtet, wenn die Calciumnitratkonzentration auf 10% anstieg.
Abwasser- oder Abwasserbehandlung
Calciumnitrat wird verwendet, um Gerüche aus dem Abwasser zu reduzieren, indem die Erzeugung von Schwefelwasserstoff reduziert wird. Darüber hinaus wird die organische Substanz verbraucht, die anaerobe Bedingungen erzeugt, was es vielen biologischen Arten schwer macht, zu überleben..
Kalte Kompressen machen
Calciumnitrat-Tetrahydrat ist eine endotherme Verbindung, dh es kann Wärme aus der Umgebung absorbieren. Dies führt zu einer Abkühlung der Körper, die mit den darin enthaltenen Behältern in Kontakt kommen..
Die Kompressen erhöhen ihre Temperatur und um sie zu regenerieren, reicht es aus, sie in einen Gefrierschrank zu stellen
Latexkoagulation
Calciumnitrat wird in der Latexkoagulationsphase verwendet. Es ist Teil der Immersionslösung, und wenn es mit der den Latex enthaltenden Lösung in Kontakt kommt, bricht es seine Stabilisierung und bewirkt seine Koagulation..
Wärmeübertragung und Speicherung
Das binäre Gemisch aus geschmolzenen Nitratsalzen, einschließlich Calcium mit anderen Nitraten, wird anstelle von Thermoöl in Solarkraftwerken zur Wärmeübertragung und -speicherung verwendet.
Antragsformen
-Calciumnitrat wird gemischt mit dem Boden in einer Konzentration von 1,59 kg pro 30,48 m aufgetragenzwei, mit ausreichender Bewässerung. Calciumnitrat wird in Wasser gelöst und kann von den Wurzeln der Pflanze aufgenommen werden. In Hydrokulturen löst es sich in wachsendem Wasser auf.
-Calciumnitrat wird auch in Form eines Sprays zum Sprühen der Blätter und Blüten verwendet. Es ist eine wirksame Behandlung zur Verhinderung der Verrottung der Tomatenblüte, des Korkflecks und der bitteren Grube des Apfels..
-Der betonbildenden Mischung (Zement, Sand, Steine und Wasser) wird eine Menge Calciumnitrat zugesetzt, und die Auswirkung ihrer Zugabe auf die spezifischen Eigenschaften des Betons wird bestimmt. wie das Einstellen von Geschwindigkeit und Stärke.
-Calciumnitrat wird in einer geeigneten Konzentration zugesetzt, um Gerüche aus Abwasser oder Abwasser so weit zu reduzieren, dass Gerüche für Menschen tolerierbar sind.
Verweise
- Bonnie L. Grant. (2019). Kalziumnitratdünger - Was bewirkt Kalziumnitrat für Pflanzen? Wiederhergestellt von: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. und Vyn, T.J. (1990). Die Verwendung von Calciumnitrat zur Verringerung der Phytotoxinakkumulation während der Zersetzung von Körperresten. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. und Hassan, I.O. (2011). Einfluss der Zugabe von Calciumnitrat auf die selektiven Eigenschaften von Beton, der Vulkanasche enthält. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Calciumnitrat. Wiederhergestellt von: en.wikipedia.org
- Shiqi Dong & col. (2018). Stahlkorrosionsinhibierung durch Calciumnitrat in mit Halogenid angereicherten Fertigstellungsflüssigkeitsumgebungen. npj Materialien Abbau Band 2, Artikelnummer: 32.
- Emaginationz Technologies. (2019). Calciumnitrat-Spezifikationen. Wiederhergestellt von: direct2farmer.com
- PubChem. (2019). Calciumnitrat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.