
Carnot-Maschinenformeln, Funktionsweise und Anwendungen

Das Carnot-Maschine Es ist ein ideales zyklisches Modell, bei dem Wärme für die Arbeit verwendet wird. Das System kann als ein Kolben verstanden werden, der sich in einem Zylinder bewegt und ein Gas komprimiert. Der ausgeübte Zyklus ist der von Carnot, der vom Vater der Thermodynamik, dem französischen Physiker und Ingenieur Nicolas Léonard Sadi Carnot, ausgesprochen wurde..
Carnot sprach diesen Zyklus im frühen neunzehnten Jahrhundert aus. Die Maschine ist vier Zustandsänderungen ausgesetzt, wechselnden Bedingungen wie Temperatur und konstantem Druck, wobei eine Änderung des Volumens beim Komprimieren und Ausdehnen des Gases nachgewiesen wird.
Artikelverzeichnis
- 1 Formeln
- 1.1 Isotherme Expansion (A → B)
- 1.2 Adiabatische Expansion (B → C)
- 1.3 Isotherme Kompression (C → D)
- 1.4 Adiabatische Kompression (D → A)
- 2 Wie funktioniert die Carnot-Maschine??
- 3 Anwendungen
- 4 Referenzen
Formeln
Laut Carnot ist es möglich, die erzielte Leistung zu maximieren, wenn die ideale Maschine Temperatur- und Druckschwankungen ausgesetzt wird.
Der Carnot-Zyklus muss in jeder seiner vier Phasen separat analysiert werden: isotherme Expansion, adiabatische Expansion, isotherme Kompression und adiabatische Kompression..
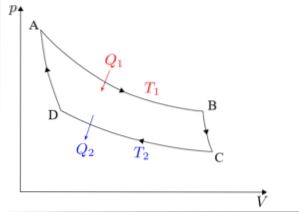
Die Formeln, die jeder der Phasen des Zyklus zugeordnet sind, die in Carnots Maschine ausgeführt werden, werden nachstehend detailliert beschrieben..
Isotherme Expansion (A → B)
Die Prämissen dieser Phase sind folgende:
- Gasvolumen: geht von minimalem Volumen zu mittlerem Volumen.
- Maschinentemperatur: konstante Temperatur T1, hoher Wert (T1> T2).
- Maschinendruck: fällt von P1 auf P2 ab.
Der isotherme Prozess impliziert, dass die Temperatur T1 während dieser Phase nicht variiert. Die Wärmeübertragung induziert eine Gasexpansion, die eine Bewegung auf dem Kolben induziert und mechanische Arbeit erzeugt.
Wenn sich das Gas ausdehnt, neigt es zur Abkühlung. Es absorbiert jedoch die von der Temperaturquelle abgegebene Wärme und hält während ihrer Expansion die Temperatur konstant..
Da die Temperatur während dieses Prozesses konstant bleibt, ändert sich die innere Energie des Gases nicht und die gesamte vom Gas absorbierte Wärme wird effektiv in Arbeit umgewandelt. A) Ja:
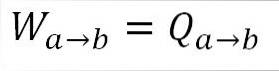
Am Ende dieser Phase des Zyklus ist es auch möglich, den Druckwert unter Verwendung der idealen Gasgleichung zu erhalten. Somit haben wir folgendes:
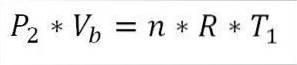
In diesem Ausdruck:
P.zwei: Druck am Ende der Phase.
V.b: Lautstärke am Punkt b.
n: Anzahl der Mol Gas.
A: Universelle Konstante idealer Gase. R = 0,082 (atm · Liter) / (Mol · K).
T1: Anfängliche absolute Temperatur, Grad Kelvin.
Adiabatische Expansion (B → C)
Während dieser Phase des Prozesses findet eine Gasexpansion statt, ohne dass Wärme ausgetauscht werden muss. Daher sind die Räumlichkeiten nachstehend aufgeführt:
- Gasvolumen: geht von mittlerem Volumen zu maximalem Volumen.
- Maschinentemperatur: fällt von T1 auf T2.
- Maschinendruck: konstanter Druck P2.
Der adiabatische Prozess impliziert, dass der Druck P2 während dieser Phase nicht variiert. Die Temperatur nimmt ab und das Gas expandiert weiter, bis es sein maximales Volumen erreicht. Das heißt, der Kolben erreicht den Anschlag.
In diesem Fall stammt die geleistete Arbeit aus der inneren Energie des Gases und sein Wert ist negativ, da die Energie während dieses Prozesses abnimmt..
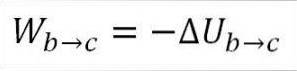
Unter der Annahme, dass es sich um ein ideales Gas handelt, geht die Theorie davon aus, dass Gasmoleküle nur kinetische Energie haben. Nach den Prinzipien der Thermodynamik kann dies durch die folgende Formel abgeleitet werden:
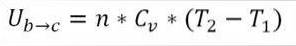
In dieser Formel:
∆Ub → c: Variation der inneren Energie des idealen Gases zwischen den Punkten b und c.
n: Anzahl der Mol Gas.
Lebenslauf: Molare Wärmekapazität von Gas.
T1: Anfängliche absolute Temperatur, Grad Kelvin.
T2: Absolute Endtemperatur, Grad Kelvin.
Isotherme Kompression (C → D)
In dieser Phase beginnt die Kompression des Gases; Das heißt, der Kolben bewegt sich in den Zylinder, mit dem das Gas sein Volumen zusammenzieht.
Die Bedingungen, die dieser Phase des Prozesses inhärent sind, sind nachstehend aufgeführt:
- Gasvolumen: geht vom Maximalvolumen zum Zwischenvolumen.
- Maschinentemperatur: konstante Temperatur T2, reduzierter Wert (T2 < T1).
- Maschinendruck: steigt von P2 auf P1.
Hier steigt der Druck auf das Gas an, so dass es zu komprimieren beginnt. Die Temperatur bleibt jedoch konstant und daher ist die Variation der inneren Energie des Gases Null.
Analog zur isothermen Expansion entspricht die geleistete Arbeit der Wärme des Systems. A) Ja:
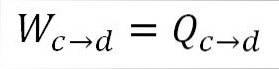
Es ist auch möglich, den Druck an diesem Punkt unter Verwendung der idealen Gasgleichung zu ermitteln.
Adiabatische Kompression (D → A)
Dies ist die letzte Phase des Prozesses, in der das System zu seinen ursprünglichen Bedingungen zurückkehrt. Hierzu werden folgende Bedingungen berücksichtigt:
- Gasvolumen: geht von einem Zwischenvolumen zu einem Mindestvolumen.
- Maschinentemperatur: steigt von T2 auf T1.
- Maschinendruck: konstanter Druck P1.
Die in der vorherigen Phase in das System eingebaute Wärmequelle wird entfernt, so dass das ideale Gas seine Temperatur erhöht, solange der Druck konstant bleibt..
Das Gas kehrt zu den anfänglichen Temperaturbedingungen (T1) und zu seinem Volumen (Minimum) zurück. Wieder einmal kommt die geleistete Arbeit von der inneren Energie des Gases, also müssen Sie:
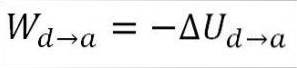
Ähnlich wie bei der adiabatischen Expansion ist es möglich, die Variation der Gasenergie mittels des folgenden mathematischen Ausdrucks zu erhalten:
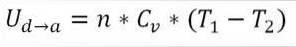
Wie funktioniert die Carnot-Maschine??
Der Carnot-Motor arbeitet als Motor, bei dem die Leistung durch Variation der isothermen und adiabatischen Prozesse maximiert wird, wobei die Expansions- und Kompressionsphasen eines idealen Gases abwechseln..
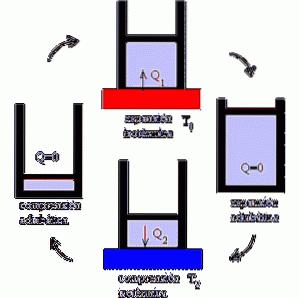
Der Mechanismus kann als eine ideale Vorrichtung verstanden werden, die Arbeiten ausführt, die Wärmeschwankungen ausgesetzt sind, da zwei Temperaturquellen vorhanden sind.
Im ersten Fokus ist das System einer Temperatur T1 ausgesetzt. Es ist eine hohe Temperatur, die das System belastet und eine Ausdehnung des Gases bewirkt..
Dies führt wiederum zur Ausführung einer mechanischen Arbeit, die die Mobilisierung des Kolbens aus dem Zylinder ermöglicht und deren Stopp nur durch adiabatische Expansion möglich ist.
Dann kommt der zweite Fokus, bei dem das System einer Temperatur T2 ausgesetzt ist, die niedriger als T1 ist; das heißt, der Mechanismus wird einer Kühlung unterzogen.
Dies induziert die Wärmeentnahme und das Zerkleinern des Gases, das nach adiabatischer Kompression sein ursprüngliches Volumen erreicht..
Anwendungen
Die Carnot-Maschine ist aufgrund ihres Beitrags zum Verständnis der wichtigsten Aspekte der Thermodynamik weit verbreitet.
Dieses Modell ermöglicht ein klares Verständnis der Variationen idealer Gase, die Temperatur- und Druckänderungen unterliegen, und ist somit eine Referenzmethode bei der Konstruktion realer Motoren..
Verweise
- Carnot Heat Engine Cycle und das 2. Gesetz (s.f.). Wiederhergestellt von: nptel.ac.in
- Castellano, G. (2018). Carnot Maschine. Wiederhergestellt von: famaf.unc.edu.ar
- Carnot-Zyklus (s.f.) Ecured. Havanna Kuba. Wiederhergestellt von: ecured.cu
- Der Carnot-Zyklus (s.f.). Wiederhergestellt von: sc.ehu.es
- Fowler, M. (s.f.). Wärmekraftmaschinen: der Carnot-Zyklus. Wiederhergestellt von: galileo.phys.virginia.edu
- Wikipedia, die freie Enzyklopädie (2016). Carnot Maschine. Wiederhergestellt von: es.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.