
Natriumphosphatstruktur, Eigenschaften, Synthese, Verwendung

Das Natriumphosphat ist ein anorganisches Salz, dessen chemische Formel Na ist3PO4. Es wird auch Trinatriumphosphat (TSP) genannt: Trinatriumphosphat) oder tribasisches Natriumphosphat, weil es überhaupt nicht in der Lage ist, Wasserstoffionen H abzugeben+.
Wenn es im Plural als Natriumphosphate bezeichnet wird, bezieht es sich auf das gesamte Kompendium von Salzen, hydratisiert oder nicht, die aus elektrostatischen Wechselwirkungen zwischen Na stammen+ und die PO43-. Einige dieser Salze bestehen sogar aus Natriumpyrophosphaten oder anorganischen Polymeren mit PO43- als Monomer.

Deshalb bezieht sich diese, sofern keine Spezifikation gemacht wird, immer auf das Na3PO4, und nicht NaHzweiPO4, NazweiHPO4, N / A4P.zweiODER7 noch zu irgendeinem anderen Salz.
Das obige Bild zeigt das Aussehen von Natriumphosphat, das weiße Kristalle ähnlich wie Kochsalz oder Speisesalz aufweist oder als weißes, amorph aussehendes Pulver gekauft wird. Dann ein3PO4 ist in der Lage, verschiedene Hydrate zu bilden, nämlich Na3PO412HzweiOder derjenige, der am meisten vermarktet wird.
Es findet hauptsächlich Verwendung in der Lebensmittelindustrie, in Waschmitteln, Sportergänzungsmitteln und dient als hyperosmotisches Abführmittel.
Artikelverzeichnis
- 1 Chemische Struktur
- 2 Eigenschaften
- 2.1 Aussehen
- 2.2 Schmelzpunkt
- 2.3 Siedepunkt
- 2.4 Löslichkeit in Wasser
- 2.5 Dichte
- 2.6 Stabilität
- 2,7 pH
- 3 Synthese
- 4 Verwendungen
- 4.1 Lebensmittel
- 4.2 Reinigungsmittel
- 4.3 Medizin
- 5 Referenzen
Chemische Struktur
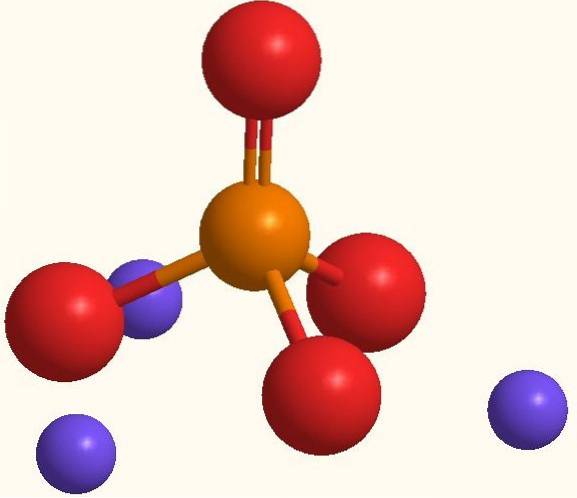
Die gleiche Formel Na3PO4 gibt das für jedes PO-Anion an43- Es gibt drei Na-Kationen+. Diese Ionen sind im obigen Bild zu sehen. Beachten Sie, dass die Bestellung43- hat eine tetraedrische Geometrie, wobei seine Sauerstoffatome eine negative Resonanzladung tragen, die das Na anzieht+ der Umwelt.
Ebenso ist die Formel Na3PO4 weist darauf hin, dass es sich um das wasserfreie Salz handelt, sodass in seinen Kristallen keine Wassermoleküle enthalten sind. Die elektrostatischen Anziehungskräfte zwischen Na+ und die PO43- Am Ende definieren sie einen trigonalen weißen Kristall. Seine Ionenbindung ist so, dass Na3PO4 hat einen Schmelzpunkt von 1583 ºC, der erheblich höher ist als der verschiedener Salze.
Sowohl die Na+ wie die PO43- Es sind Ionen, die stark hydratisiert werden können, ohne die Stabilität der Kristalle negativ zu beeinflussen.
Aus diesem Grund können auch Hydrate kristallisieren; seine Schmelzpunkte sind jedoch niedriger als die des wasserfreien Salzes, da die intermolekularen Wasserstoffbrückenbindungen in Wasser die Ionen trennen und ihre Wechselwirkungen schwächen. In der Na3PO412HzweiOder zum Beispiel liegt sein Schmelzpunkt bei 73,4 ºC, viel niedriger als der von Na3PO4.
Eigenschaften
Aussehen
Es kann als definierte weiße Kristalle oder als Pulver oder Granulat derselben Farbe erscheinen. Alle nachstehend angegebenen physikalischen Größen beziehen sich nur auf das wasserfreie Salz Na3PO4.
Schmelzpunkt
1583 ºC
Siedepunkt
100 ºC
Wasserlöslichkeit
14,5 g / 100 ml bei 25 ºC, weshalb es als in Wasser gut lösliches Phosphat angesehen wird. Es ist jedoch in organischen Lösungsmitteln wie Ethanol und Schwefelkohlenstoff unlöslich..
Dichte
2,536 g / cm3 bei 17,5 ºC.
Stabilität
Es ist ein hygroskopischer Feststoff. Daher sollte es so gelagert werden, dass es keiner Feuchtigkeit ausgesetzt werden kann.
pH
Es ist ein stark alkalisches Salz. Beispielsweise hat eine 0,1% ige wässrige Lösung davon bereits einen pH-Wert von 11,5. Diese Eigenschaft dient als Additiv in Waschmitteln.
Synthese
Wie wird Natriumphosphat hergestellt oder synthetisiert? Dazu gehen wir von Phosphorsäure H aus3PO4, oder des Natriumsäurephosphatsalzes NaHzweiPO4.
In der überwiegenden Mehrheit der Synthesen wird H bevorzugt3PO4. Somit wird das H umgesetzt3PO4 mit einer Base, die ihre drei OH-Gruppen neutralisiert, wobei berücksichtigt wird, dass diese Säure auch als PO (OH) geschrieben werden kann.3.
Die Base ist bevorzugt Natriumhydroxid, NaOH (in Deutschland), aber es ist auch möglich (und billiger), Natriumcarbonat oder Soda, Na, zu verwendenzweiCO3 (In den Vereinigten Staaten). Die Gleichungen für beide Neutralisationsreaktionen sind:
N / AzweiCO3 + H.3PO4 → NazweiHPO4 + COzwei + H.zweiODER
N / AzweiHPO4 + NaOH → Na3PO4 + H.zweiODER
Beachten Sie, dass bei Verwendung von NazweiCO3 Na wird nicht erhalten3PO4 aber die NazweiHPO4, die eine anschließende Neutralisierung benötigen. Da das Reaktionsmedium wässrig ist, kristallisiert Na3PO412HzweiOder es muss kalziniert werden, um seinen Wassergehalt zu entfernen und so das wasserfreie Salz zu erzeugen.
Dann ein3PO412HzweiOder es zeichnet sich dadurch aus, dass es seine Kristalle zu einer kompakten Masse "verschmilzt", die schwer zu brechen ist. Je kleiner Ihre Kristalle sind, desto schneller kalzinieren sie.
Anwendungen
Essen

Bei der Verwendung von Natriumphosphat ist es unvermeidlich, das Na zu mischen3PO4 oder zu Na3PO412HzweiOder da letzteres das am meisten kommerzialisierte Hydrat ist. Zum Beispiel trägt eines der beiden (theoretisch) harmlose Ionen zu den Lebensmitteln bei, denen sie zugesetzt werden, indem es sie mit Phosphaten anreichert und gleichzeitig ihren Salzgehalt erhöht..
Im Salz des Fleisches ist das Na3PO412HzweiOder enthalten, um sie während der Lagerung länger frisch zu halten. Ebenso wird es als Emulgator zugesetzt, damit das Öl-Wasser-Gemisch nicht "schneidet", sondern vereint bleibt; und als pH-Regler, da er dazu beiträgt, den Säuregehalt von Lebensmitteln (einschließlich Getreide) zu verringern..
Darüber hinaus wird es zum Eindicken einiger Tomatensaucen und zum Backen von Kuchen oder Brot verwendet (oberes Bild). Letzteres ist auf das Na zurückzuführen3PO412HzweiOder es neigt dazu, Wasserdampf freizusetzen, was die Porengröße und das Volumen des Mehlteigs erhöht..
Reinigungsmittel
Natriumphosphat ist basisch genug, um einige Fette oder Öle zu verseifen, mit denen es in Kontakt kommt. Seine Alkalität wird dann verwendet, um die Wirkung von Waschmitteln zu verbessern, solange die zu entfettende Oberfläche nicht metallisch ist, da sie sie verschlechtern können..
Die Produktion von mit Phosphaten angereicherten Waschmitteln wurde jedoch aufgrund der Eutrophierung von Seen und Flüssen und damit der Verbreitung von Algen, die ihre Oberflächen bedecken, verringert..
Es wurde auch zur Herstellung eines Desinfektionsmittels verwendet: Na3PO41 / 4NaOCl11HzweiOder das unter Verwendung von Natriumhypochlorit, NaOCl, anstelle von NaOH oder Na hergestellt wirdzweiCO3 das H zu neutralisieren3PO4.
Medizinisch
Dann ein3PO4 Es induziert eine Defäkation, indem es als hyperosmotisches Abführmittel wirkt, das zur Reinigung des Dickdarms erforderlich ist, bevor der Patient einer Koloskopie unterzogen wird. Andererseits wurde es auch in Energiezusätzen verwendet (hinzugefügt).
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Trinatriumphosphat. PubChem-Datenbank. CID = 24243. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Trinatriumphosphat. Wiederhergestellt von: en.wikipedia.org
- Curran M.P. & Plosker G.L. (2004). Orale Natriumphosphatlösung: eine Überprüfung ihrer Verwendung als kolorektales Reinigungsmittel. DOI: 10.2165 / 00003495-200464150-00009
- Corey Whelan. (22. Dezember 2017). Natriumphosphat. Wiederhergestellt von: healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Verfahren zur Herstellung von Trinatriumphosphat. Wiederhergestellt von: freepatentsonline.com
- MaryAnn Marks. (2018). Warum wird unserer Nahrung Trinatriumphosphat (TSP) zugesetzt? Wiederhergestellt von: theingredientguru.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.