
Dipolmoment wie es berechnet wird und Beispiele
Das Dipolmoment ist eine chemische Eigenschaft, die angibt, wie heterogen elektrische Ladungen in einem Molekül verteilt sind. Es wird in Debye-Einheiten ausgedrückt, 3,33 · 10-30 C · m und im Allgemeinen reichen seine Werte von 0 bis 11 D..
Hochpolare Verbindungen neigen dazu, große Dipolmomente zu haben; während die unpolaren kleine Dipolmomente. Je polarisierter die elektrischen Ladungen in einem Molekül sind, desto größer ist sein Dipolmoment; das heißt, es muss eine Region geben, die reich an Elektronen ist, δ-, und eine andere, die arm an Elektronen ist, δ+.

Das Dipolmoment μ ist eine Vektorgröße, daher wird es von den Winkeln der Bindungen und im Allgemeinen von der Molekülstruktur beeinflusst.
Wenn das Molekül linear ist, kann es mit einem zweifarbigen Radiergummi verglichen werden. Sein negatives Ende δ- würde der Farbe Rot entsprechen; während das Positive δ + die blaue Farbe wäre. Wenn die Größen der negativen Ladungen am δ-Pol zunehmen und der Abstand, der sie von δ + trennt, zunimmt, nimmt das Dipolmoment zu.
Chemisch bedeutet dies, dass das Dipolmoment zwischen ihnen umso größer ist, je größer der Unterschied in der Elektronegativität zwischen zwei Atomen ist und je länger der Abstand zwischen ihnen ist..
Artikelverzeichnis
- 1 Wie berechnet sich das Dipolmoment??
- 2 Beispiele
- 2.1 Wasser
- 2.2 Methanol
- 2.3 Ammoniak
- 2.4 Ethanol
- 2.5 Kohlendioxid
- 2.6 Methan
- 3 Referenzen
Wie berechnet man das Dipolmoment??
Es wird als kovalente Bindung zwischen zwei Atomen A und B angesehen:
A-B
Der Abstand zwischen den positiven und negativen Teilladungen ist bereits durch die Länge ihrer Bindung definiert:
ZUδ+-B.δ-
Da Protonen und Elektronen die gleiche Größe der elektrischen Ladung haben, jedoch mit entgegengesetzten Vorzeichen, 1,6 · 10-19C, dies ist derjenige, der bei der Bewertung des Dipolmoments zwischen A und B unter Verwendung der folgenden Gleichung berücksichtigt wird:
μ = δd
Wobei μ das Dipolmoment ist, ist δ die Ladung des Elektrons ohne negatives Vorzeichen und d Die Länge der Verbindung in Metern. Zum Beispiel unter der Annahme, dass d hat einen Wert von 2 Å (1 10-10m) das Dipolmoment μA-B ist:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29Cm
Da dieser Wert jedoch sehr klein ist, wird die Debye-Einheit verwendet:
μ = (3,210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D.
Dieser Wert von μA-B könnte annehmen, dass die Bindung A-B mehr ionisch als kovalent ist.
Beispiele
Wasser
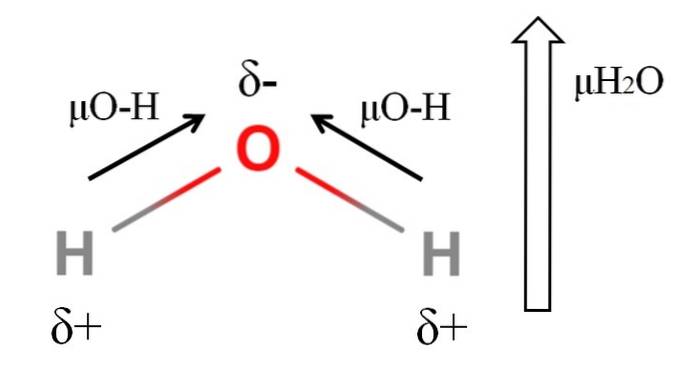
Um das Dipolmoment eines Moleküls zu berechnen, müssen alle Dipolmomente ihrer jeweiligen Bindungen unter Berücksichtigung der Bindungswinkel und ein wenig Trigonometrie vektoriell addiert werden. Dies am Anfang.
Wasser hat eines der größten Dipolmomente, die für eine kovalente Verbindung zu erwarten sind. Im oberen Bild haben wir, dass Wasserstoffatome positive Teilladungen δ + haben, während Sauerstoff eine negative Teilladung δ- trägt. Die O-H-Bindung ist ziemlich polar (1,5D), und es gibt zwei davon in einem H-MolekülzweiODER.
Normalerweise wird ein Vektor gezeichnet, der vom am wenigsten elektronegativen Atom (H) zum am meisten elektronegativen (O) gerichtet ist. Obwohl sie nicht gezeichnet sind, befinden sich am Sauerstoffatom zwei Paare ungeteilter Elektronen, die den negativen Bereich weiter „konzentrieren“..
Aufgrund der Winkelgeometrie des H.zweiOder die Dipolmomente addieren sich in Richtung des Sauerstoffatoms. Beachten Sie, dass die Summe der beiden μO-H 3D (1,5 + 1,5) ergeben würde; aber so ist es nicht. Das Dipolmoment von Wasser hat einen experimentellen Wert von 1,85D. Der Effekt des Winkels nahe 105º zwischen den H-O-H-Bindungen wird hier gezeigt..
Methanol
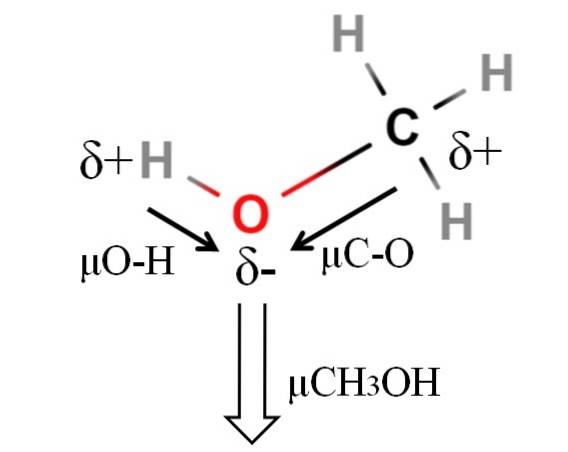
Das Dipolmoment von Methanol beträgt 1,69D. Es ist weniger als das von Wasser. Daher haben die Atommassen keinen großen Einfluss auf das Dipolmoment; aber ihre Atomradien sind. Im Fall von Methanol können wir nicht bestätigen, dass seine H-O-Bindung ein μ von 1,5D hat; da die molekularen Umgebungen in CH unterschiedlich sind3OH und H.zweiODER.
Deshalb müsste die Länge der H-O-Bindung in Methanol gemessen werden, um μO-H zu berechnen. Was gesagt werden kann ist, dass μO-H größer als μC-O ist, da der Elektronegativitätsunterschied zwischen Kohlenstoff und Sauerstoff geringer ist als zwischen Wasserstoff und Sauerstoff..
Methanol ist neben Wasser und Ammoniak eines der polarsten Lösungsmittel..
Ammoniak
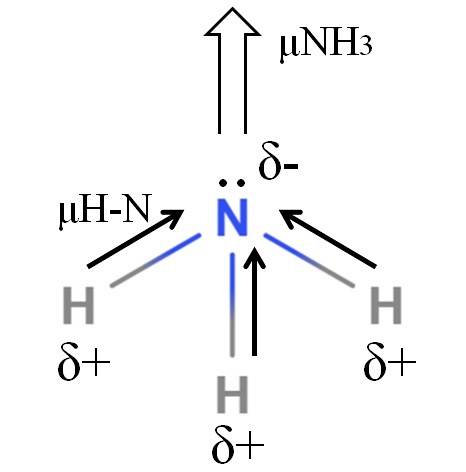
Die H-N-Bindungen sind ziemlich polar, so dass Stickstoff aufgrund seiner höheren Elektronegativität Elektronen zu sich selbst anzieht (oberes Bild). Darüber hinaus haben wir ein ungeteiltes Elektronenpaar, das ihre negativen Ladungen in die δ-Region einbringt. Daher überwiegen elektrische Ladungen am Stickstoffatom von Ammoniak..
Ammoniak hat ein Dipolmoment von 1,42 D, weniger als das von Methanol. Wenn sowohl Ammoniak als auch Methanol in Zugluft umgewandelt werden könnten, würde man sehen, dass der Methanolzug im Vergleich zum Ammoniakzug definierte Pole aufweist.
Ethanol
Im Fall von Ethanol wurde CH3CHzweiOH, sein Dipolmoment ist dem von Methanol sehr nahe, aber es neigt dazu, niedrigere Werte zu haben. Da mehr Kohlenstoffatome die δ + -Region bilden, beginnt das Sauerstoffatom, das δ- darstellt, etwas von seiner "relativen negativen Intensität" zu verlieren..
Kohlendioxid
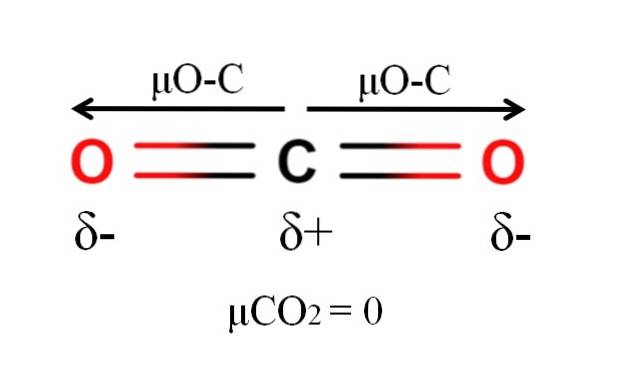
Kohlendioxid hat zwei polare Bindungen, C = O, mit ihren jeweiligen Dipolmomenten μO-C. Wie im obigen Bild zu sehen ist, ist jedoch die lineare Geometrie von COzwei bewirkt, dass sich die beiden μO-C vektoriell aufheben, selbst wenn Kohlenstoff eine positive Teilladung und Sauerstoff negative Teilladungen aufweist.
Aus diesem Grund ist Kohlendioxid ein unpolares Molekül, da μCOzwei hat einen Wert von 0D.
Methan
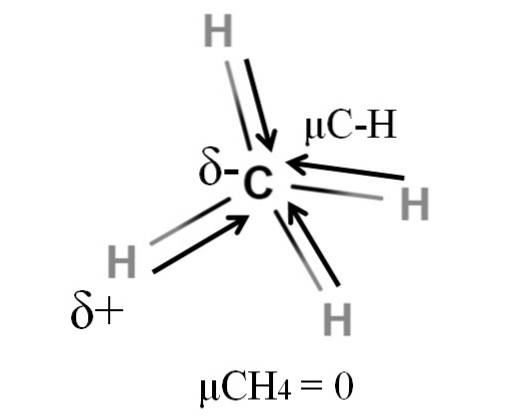
Sowohl Methan als auch Kohlendioxid haben etwas gemeinsam: Sie sind hochsymmetrische Moleküle. Im Allgemeinen ist sein Dipolmoment umso kleiner, je symmetrischer ein Molekül ist..
Wenn wir das CH-Molekül sehen4, Seine CH-Bindungen sind polar und die Elektronen sind auf das Kohlenstoffatom gerichtet, weil es etwas elektronegativer ist. Es könnte angenommen werden, dass Kohlenstoff eine stark negative δ-Region sein müsste; wie ein Radiergummi mit seiner tiefroten Mitte und den bläulichen Enden.
Durch Teilen des CH4 in der Hälfte würden wir zwei H-C-H-Hälften erhalten, eine links und eine rechts, ähnlich dem H-MolekülzweiO. Somit würde sich das Dipolmoment, das sich aus der Zugabe dieser beiden μC-H ergibt, mit dem der anderen Hälfte aufheben. Und deshalb μCH4 hat einen Wert von 0D.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Ira N. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, S. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29. Januar 2020). Dipolmoment Definition. Wiederhergestellt von :oughtco.com
- Blaber Mike. (29. September 2019). Dipolmomente. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- LaRita Williams. (2020). Dipolmoment: Definition, Gleichung & Beispiele. Studie. Wiederhergestellt von: study.com
- Wikipedia. (2020). Bond-Dipol-Moment. Wiederhergestellt von: en.wikipedia.org


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.