
Ritchter-Wenzel Law Stories, Statements und Beispiele

Das Ritchter-Wenzel-Gesetz oder der reziproke Anteil ist einer, der feststellt, dass die Massenanteile zwischen zwei Verbindungen es ermöglichen, den einer dritten Verbindung zu bestimmen. Es ist neben dem Lavoisier-Gesetz (Gesetz der Massenerhaltung) eines der Gesetze der Stöchiometrie; Prousts Gesetz (Gesetz bestimmter Proportionen); und Daltons Gesetz (Gesetz von mehreren Anteilen).
Ritcher sprach sein Gesetz 1792 in einem Buch aus, das die Grundlagen der Stöchiometrie definierte und auf den Forschungsarbeiten von Carl F. Wenzel basierte, der 1777 die erste Äquivalenztabelle für Säuren und Basen veröffentlichte..
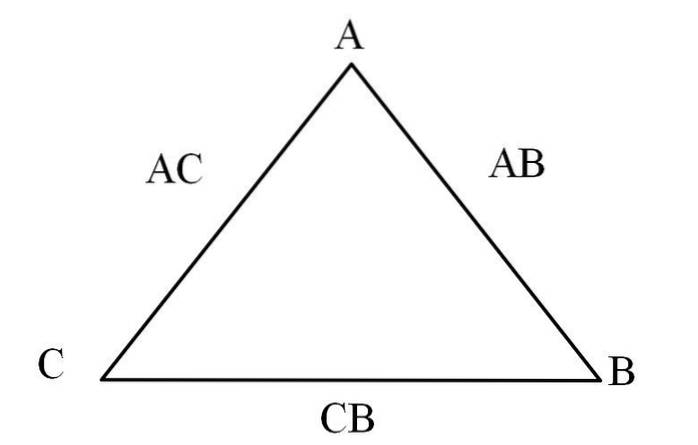
Eine einfache Möglichkeit, dies zu visualisieren, ist ein „Dreieck der Reziprozität“ (Bild oben). Wenn Sie die Massen von A, C und B kennen, die sich mischen, um die Verbindungen AC und AB zu bilden, können Sie bestimmen, wie viel C und B sich mischen oder reagieren, um die Verbindung CB zu bilden.
In den Verbindungen AC und AB ist Element A in beiden vorhanden, so dass durch Teilen ihrer Massenanteile herausgefunden wird, wie viel C mit B reagiert.
Artikelverzeichnis
- 1 Geschichte und Allgemeingültigkeit des Gesetzes von gegenseitigen Ausmaßen
- 2 Aussagen und Konsequenzen
- 3 Beispiele
- 3.1 Calciumchlorid
- 3.2 Schwefeloxide
- 3.3 Eisensulfid und -oxid
- 4 Referenzen
Geschichte und Allgemeingültigkeit des Gesetzes von gegenseitigen Ausmaßen
Richter stellte fest, dass das Gewichtsverhältnis der bei einer chemischen Reaktion verbrauchten Verbindungen immer gleich ist.
In diesem Zusammenhang stellte Ritcher fest, dass 615 Gewichtsteile Magnesia (MgO) erforderlich sind, um beispielsweise 1000 Gewichtsteile Schwefelsäure zu neutralisieren.
Zwischen 1792 und 1794 veröffentlichte Ritcher eine dreibändige Zusammenfassung, die seine Arbeit über das Gesetz bestimmter Proportionen enthielt. Die Zusammenfassung befasste sich mit Stöchiometrie und definierte sie als die Kunst chemischer Messungen..
Unter Hinweis darauf, dass sich die Stöchiometrie mit den Gesetzen befasst, nach denen sich Substanzen zu Verbindungen vereinigen. Richters Forschungsarbeit wurde jedoch für die von ihm verwendete mathematische Behandlung kritisiert, und es wurde sogar darauf hingewiesen, dass er seine Ergebnisse anpasste.
Im Jahr 1802 veröffentlichte Ernst Gottfried Fischer die erste Tabelle chemischer Äquivalente, in der Schwefelsäure mit der Zahl 1000 verwendet wurde. ähnlich dem von Richter gefundenen Wert für die Neutralisation von Schwefelsäure durch Magnesia.
Es wurde jedoch festgestellt, dass Richter eine Tabelle mit Kombinationsgewichten erstellte, die die Geschwindigkeit angab, mit der eine Reihe von Verbindungen reagierten. Beispielsweise wird angegeben, dass 859 Teile NaOH 712 Teile HNO neutralisieren3.
Aussagen und Konsequenzen
Die Aussage des Richter-Wenzel-Gesetzes lautet wie folgt: Die Massen zweier verschiedener Elemente, die mit der gleichen Menge eines dritten Elements kombiniert werden, behalten die gleiche Beziehung wie die Massen dieser Elemente, wenn sie miteinander kombiniert werden.
Dieses Gesetz erlaubte es, das Äquivalentgewicht oder Gewichtsäquivalentgramm als die Menge eines Elements oder einer Verbindung festzulegen, die mit einer festen Menge einer Referenzsubstanz reagiert.
Richter nannte Kombinationsgewichte relativ zu den Gewichten der Elemente, die mit jedem Gramm Wasserstoff kombiniert wurden. Die relativen Kombinationsgewichte von Richter entsprechen dem derzeit als Äquivalentgewicht der Elemente oder Verbindungen bekannten Gewicht.
In Übereinstimmung mit dem vorherigen Ansatz kann das Richter-Wenzel-Gesetz wie folgt angegeben werden:
Die Kombinationsgewichte verschiedener Elemente, die mit einem bestimmten Gewicht eines bestimmten Elements kombiniert werden, sind die relativen Kombinationsgewichte dieser Elemente, wenn sie miteinander kombiniert werden, oder Vielfache oder Untermultiplikatoren dieser Mengenbeziehungen.
Beispiele
Calciumchlorid
In Calciumoxid (CaO) verbinden sich 40 g Calcium mit 16 g Sauerstoff (O). Inzwischen in hypochlorigem Oxid (ClzweiO) 71 g Chlor werden mit 16 g Sauerstoff kombiniert. Welche Verbindung würde Kalzium in Kombination mit Chlor bilden??
Unter Verwendung des Reziprozitätsdreiecks ist Sauerstoff das gemeinsame Element für die beiden Verbindungen. Zunächst werden die Massenanteile der beiden Oxygenate bestimmt:
40 g Ca / 16 gO = 5 g Ca / 2 g O.
71 g Cl / 16 g O.
Und nun teilen wir die beiden Massenanteile von CaO und ClzweiOder wir haben:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Beachten Sie, dass das Gesetz der Massenanteile erfüllt ist: 40 g Calcium reagieren mit 71 g Chlor.
Schwefeloxide
Sauerstoff und Schwefel reagieren mit Kupfer zu Kupferoxid (CuO) bzw. Kupfersulfid (CuS). Wie viel Schwefel würde mit Sauerstoff reagieren?
In Kupferoxid werden 63,5 g Kupfer mit 16 g Sauerstoff kombiniert. In Kupfersulfid binden 63,5 g Kupfer an 32 g Schwefel. Teilen Sie die Massenanteile, die wir haben:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O.
Das Massenverhältnis 2: 1 ist ein Vielfaches von 4 (63,5 / 16), was zeigt, dass Richters Gesetz wahr ist. Mit diesem Anteil SO wird Schwefelmonoxid erhalten (32 g Schwefel reagieren mit 16 g Sauerstoff).
Wenn Sie dieses Verhältnis durch zwei teilen, erhalten Sie 1: 1. Wieder ist es jetzt ein Vielfaches von 4 oder 2, und daher geht es um die SOzwei, Schwefeldioxid (32 g Schwefel reagieren mit 32 g Sauerstoff).
Eisensulfid und Oxid
Eisensulfid (FeS), in dem 32 g Schwefel mit 56 g Eisen kombiniert sind, wird mit Eisenoxid (FeO) umgesetzt, in dem 16 g Sauerstoff mit 56 g Eisen kombiniert werden. Dieser Artikel dient als Referenz.
In den reagierenden Verbindungen FeS und FeO finden sich Schwefel (S) und Sauerstoff (O) relativ zu Eisen (Fe) im Verhältnis 2: 1. In schwefelhaltigem Oxid (SO) werden 32 g Schwefel mit 16 g Sauerstoff kombiniert, so dass Schwefel und Sauerstoff im Verhältnis 2: 1 liegen.
Dies weist darauf hin, dass das Gesetz der gegenseitigen Proportionen oder das Richter-Gesetz erfüllt ist.
Das Verhältnis zwischen Schwefel und Sauerstoff in Schwefeloxid (2: 1) könnte beispielsweise verwendet werden, um zu berechnen, wie viel Sauerstoff mit 15 g Schwefel reagiert.
g Sauerstoff = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Verweise
- Foist L. (2019). Gesetz des gegenseitigen Anteils: Definition & Beispiele. Studie. Wiederhergestellt von: study.com
- Cyber-Aufgaben. (2016, 9. Februar). Gesetz der gegenseitigen Proportionen oder Richter-Wenzel. Wiederhergestellt von: cibertareas.infol
- Wikipedia. (2018). Gesetz der gegenseitigen Proportionen. Wiederhergestellt von: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter und das Gesetz der gegenseitigen Proportionen.-II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18. Juni 2015). Gesetz der gegenseitigen Proportionen. Chemie-Libretexte. Wiederhergestellt von: chem.libretexts.org
- Wissen neu definieren. (29. Juli 2017). Gesetz der gegenseitigen Proportionen. Wiederhergestellt von: hemantmore.org.in



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.