
Avogadros Gesetzeseinheiten für Messung und Experiment
Das Avogadros Gesetz postuliert, dass ein gleiches Volumen aller Gase bei gleicher Temperatur und gleichem Druck die gleiche Anzahl von Molekülen aufweist. Amadeo Avogadro, ein italienischer Physiker, schlug 1811 zwei Hypothesen vor: Die erste besagt, dass die Atome elementarer Gase in Molekülen zusammen sind, anstatt als separate Atome zu existieren, wie John Dalton sagte..
Die zweite Hypothese besagt, dass gleiche Gasvolumina bei konstantem Druck und konstanter Temperatur die gleiche Anzahl von Molekülen aufweisen. Die Hypothese von Avogadro bezüglich der Anzahl der Moleküle in Gasen wurde erst 1858 akzeptiert, als der italienische Chemiker Stanislao Cannizaro darauf ein logisches System der Chemie aufbaute.

Aus dem Avogadroschen Gesetz kann Folgendes abgeleitet werden: Für eine gegebene Masse eines idealen Gases sind sein Volumen und die Anzahl der Moleküle direkt proportional, wenn Temperatur und Druck konstant sind. Dies impliziert auch, dass das Molvolumen der Gase, die sich ideal verhalten, für alle gleich ist.
Bei einer Anzahl von Ballons mit den Bezeichnungen A bis Z werden sie beispielsweise alle gefüllt, bis sie auf ein Volumen von 5 Litern aufgepumpt sind. Jeder Buchstabe entspricht einer anderen gasförmigen Spezies; das heißt, seine Moleküle haben ihre eigenen Eigenschaften. Das Avogadro-Gesetz besagt, dass alle Ballons die gleiche Anzahl von Molekülen enthalten.
Wenn die Ballons nach den Hypothesen von Avogadro jetzt auf 10 Liter aufgepumpt sind, wurde die doppelte Anzahl der anfänglichen gasförmigen Mol eingeführt.
Artikelverzeichnis
- 1 Woraus es besteht und Maßeinheiten
- 1.1 Abzug des Wertes von R in L atm / K mol
- 2 Übliche Form des Avogadro-Gesetzes
- 3 Konsequenzen und Implikationen
- 4 Ursprünge
- 4.1 Avogadro-Hypothese
- 4.2 Avogadro-Nummer
- 5 Avogadro-Experiment
- 5.1 Experimentieren Sie mit handelsüblichen Behältern
- 6 Beispiele
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Referenzen
Woraus es besteht und Maßeinheiten
Das Avogadro-Gesetz besagt, dass für eine Masse eines idealen Gases das Volumen des Gases und die Anzahl der Mol direkt proportional sind, wenn Temperatur und Druck konstant sind. Mathematisch kann es mit der folgenden Gleichung ausgedrückt werden:
V / n = K.
V = Volumen des Gases, allgemein ausgedrückt in Litern.
n = Menge der Substanz, gemessen in Mol.
Auch aus dem sogenannten idealen Gasgesetz haben wir folgendes:
PV = nRT
P = Gasdruck wird üblicherweise in Atmosphären (atm), in mm Quecksilber (mmHg) oder in Pascal (Pa) ausgedrückt..
V = das Volumen des Gases in Litern (L).
n = Anzahl der Mol.
T = die Temperatur des Gases, ausgedrückt in Grad Celsius, Grad Fahrenheit oder Grad Kelvin (0 ºC entspricht 273,15 K).
R = die universelle Konstante idealer Gase, die in verschiedenen Einheiten ausgedrückt werden kann, von denen die folgenden hervorstechen: 0,08205 L atm / K mol (L atm K.-1.Maulwurf-1); 8,314 J / K. mol (J.K.-1.Maulwurf-1) (J ist Joule); und 1.987 cal / Kmol (cal.K.-1.Maulwurf-1) (cal ist Kalorien).
Abzug des Wertes von R, ausgedrückt in L.Atm / K.Maulwurf
Das Volumen, das ein Mol eines Gases bei einer Druckatmosphäre und 0 ºC entsprechend 273 K einnimmt, beträgt 22,414 Liter.
R = PV / T.
R = 1 atm × 22.414 (L / Mol) / (273 ºK)
R = 0,082 l atm / mol.K.
Die ideale Gasgleichung (PV = nRT) kann wie folgt geschrieben werden:
V / n = RT / P.
Wenn Temperatur und Druck als konstant angenommen werden, weil R eine Konstante ist, dann:
RT / P = K.
Später:
V / n = K.
Dies ist eine Konsequenz des Avogadro-Gesetzes: das Bestehen einer konstanten Beziehung zwischen dem Volumen, das ein ideales Gas einnimmt, und der Anzahl der Mol dieses Gases bei konstanter Temperatur und konstantem Druck..
Übliche Form des Avogadro-Gesetzes
Wenn Sie zwei Gase haben, lautet die obige Gleichung wie folgt:
V.1/ n1= V.zwei/ nzwei
Dieser Ausdruck wird auch geschrieben als:
V.1/ V.zwei= n1/ nzwei
Das Obige zeigt die angegebene Proportionalitätsbeziehung.
In seiner Hypothese wies Avogadro darauf hin, dass zwei ideale Gase in demselben Volumen und bei derselben Temperatur und demselben Druck dieselbe Anzahl von Molekülen enthalten.
Im weiteren Sinne gilt das Gleiche für echte Gase; zum Beispiel ein gleiches Volumen von O.zwei und N.zwei enthält die gleiche Anzahl von Molekülen, wenn es die gleiche Temperatur und den gleichen Druck hat.
Reale Gase zeigen geringe Abweichungen vom idealen Verhalten. Das Avogadro-Gesetz gilt jedoch ungefähr für reale Gase bei ausreichend niedrigem Druck und hohen Temperaturen.
Konsequenzen und Implikationen
Die wichtigste Konsequenz des Avogadro-Gesetzes ist, dass die Konstante R für ideale Gase für alle Gase den gleichen Wert hat.
R = PV / nT
Wenn also R für zwei Gase konstant ist:
P.1V.1/ nT1= P.zweiV.zwei/ nzweiT.zwei = konstant
Die Suffixe 1 und 2 repräsentieren zwei verschiedene ideale Gase. Die Schlussfolgerung ist, dass die ideale Gaskonstante für 1 Mol eines Gases unabhängig von der Art des Gases ist. Dann ist das Volumen, das diese Gasmenge bei einer bestimmten Temperatur und einem bestimmten Druck einnimmt, immer gleich.
Eine Folge der Anwendung des Avogadro-Gesetzes ist die Feststellung, dass 1 Mol eines Gases bei einem Druck von 1 Atmosphäre und einer Temperatur von 0 ºC (273 K) ein Volumen von 22.414 Litern einnimmt..
Eine weitere offensichtliche Konsequenz ist die folgende: Wenn Druck und Temperatur konstant sind und die Menge eines Gases erhöht wird, nimmt auch sein Volumen zu..
Herkunft
1811 stellte Avogadro seine Hypothese auf der Grundlage von Daltons Atomtheorie und Gay-Lussacs Gesetz über die Bewegungsvektoren von Molekülen auf..
Gay-Lussac kam 1809 zu dem Schluss, dass "Gase, in welchen Anteilen sie auch kombiniert werden können, immer zu Verbindungen führen, deren Volumenelemente immer ein Vielfaches der anderen sind"..
Der gleiche Autor zeigte auch, dass "Gaskombinationen immer nach sehr einfachen Volumenverhältnissen stattfinden".
Avogadro wies darauf hin, dass chemische Reaktionen in der Gasphase molekulare Spezies sowohl der Reaktanten als auch des Produkts betreffen.
Nach dieser Aussage muss die Beziehung zwischen dem Reaktanten und den Produktmolekülen eine ganzzahlige Zahl sein, da das Vorhandensein eines Bindungsbruchs vor der Reaktion (einzelne Atome) nicht wahrscheinlich ist. Molmengen können jedoch mit Bruchwerten ausgedrückt werden.
Das Gesetz der Kombinationsvolumina zeigt seinerseits, dass die numerische Beziehung zwischen den Gasvolumina ebenfalls einfach und ganzzahlig ist. Dies führt zu einer direkten Assoziation zwischen den Volumina und der Anzahl der Moleküle der gasförmigen Spezies..
Avogadro-Hypothese
Avogadro schlug vor, dass Gasmoleküle zweiatomig sind. Dies erklärte, wie zwei Volumina molekularer Wasserstoff mit einem Volumen molekularen Sauerstoffs kombiniert werden, um zwei Volumina Wasser zu ergeben..
Darüber hinaus schlug Avogadro vor, dass, wenn gleiche Gasvolumina die gleiche Anzahl von Partikeln enthielten, die Beziehung zwischen den Dichten der Gase gleich der Beziehung zwischen den Molekularmassen dieser Partikel sein sollte..
Offensichtlich führt die Division von d1 durch d2 zum Quotienten m1 / m2, da das von den gasförmigen Massen eingenommene Volumen für beide Arten gleich ist und aufgehoben wird:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadros Nummer
Ein Mol enthält 6,022 x 102. 3 Moleküle oder Atome. Diese Zahl heißt Avogadros Zahl, obwohl er nicht derjenige war, der sie berechnet hat. Jean Pierre, Nobelpreisträger von 1926, nahm die entsprechenden Messungen vor und schlug den Namen zu Ehren von Avogadro vor.
Avogadros Experiment
Eine sehr einfache Demonstration des Avogadro-Gesetzes besteht darin, Essigsäure in eine Glasflasche zu geben und dann Natriumbicarbonat hinzuzufügen, wobei die Flaschenöffnung mit einem Ballon verschlossen wird, der das Ein- oder Austreten eines Gases aus dem Inneren der Flasche verhindert.
Essigsäure reagiert mit Natriumbicarbonat und setzt so CO freizwei. Das Gas sammelt sich im Ballon und verursacht dessen Inflation. Theoretisch ist das vom Ballon erreichte Volumen proportional zur Anzahl der CO-Molekülezwei, wie im Gesetz von Avogadro festgelegt.
Dieses Experiment hat jedoch eine Einschränkung: Der Ballon ist ein elastischer Körper; daher, wenn sich seine Wand aufgrund der Anreicherung von CO ausdehntzwei, Darin wird eine Kraft erzeugt, die seiner Ausdehnung entgegenwirkt und versucht, das Volumen des Ballons zu verringern.
Experimentieren Sie mit handelsüblichen Behältern
Ein weiteres anschauliches Experiment des Avogadro-Gesetzes ist die Verwendung von Getränkedosen und Plastikflaschen..
Bei Getränkedosen wird Backpulver hineingegossen und anschließend eine Zitronensäurelösung zugegeben. Die Verbindungen reagieren miteinander unter Freisetzung von CO-Gaszwei, welches sich in der Dose ansammelt.
Anschließend wird eine konzentrierte Natriumhydroxidlösung zugegeben, die die Funktion hat, das CO zu "sequestrieren".zwei. Der Zugang zum Inneren der Dose wird dann schnell mit Klebeband verschlossen.
Nach einer bestimmten Zeit wird beobachtet, dass sich die Dose zusammenzieht, was darauf hinweist, dass das Vorhandensein von CO abgenommen hat.zwei. Dann könnte man annehmen, dass das Volumen der Dose abnimmt, was einer Abnahme der Anzahl der CO-Moleküle entspricht.zwei, nach dem Gesetz von Avogadro.
Beim Experiment mit der Flasche wird das gleiche Verfahren wie bei der Getränkedose angewendet, und wenn das NaOH hinzugefügt wird, wird der Mund der Flasche mit dem Deckel geschlossen; Ebenso wird eine Kontraktion der Flaschenwand beobachtet. Infolgedessen kann die gleiche Analyse durchgeführt werden wie im Fall der Getränkedose..
Beispiele
Die drei folgenden Bilder veranschaulichen das Konzept des Avogadro-Gesetzes, das das Volumen, das Gase einnehmen, und die Anzahl der Moleküle von Reaktanten und Produkten in Beziehung setzt..
ODERzwei + 2Hzwei => 2HzweiODER
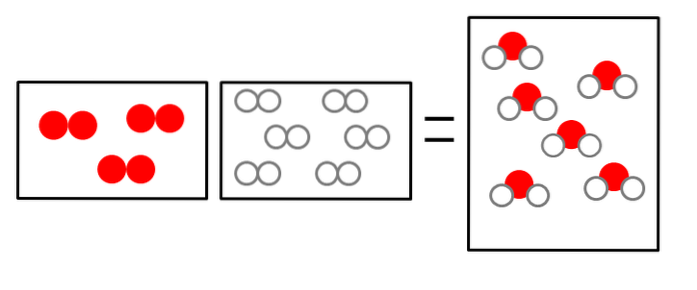
Das Volumen von Wasserstoffgas ist doppelt so groß, nimmt jedoch einen Behälter ein, der genauso groß ist wie der von gasförmigem Sauerstoff.
N.zwei + 3Hzwei => 2NH3
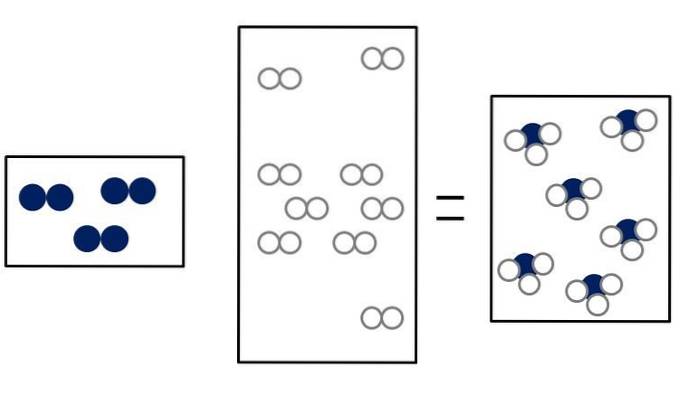
N.zwei + ODERzwei => 2NO

Verweise
- Bernard Fernandez, PhD. (Februar 2009). Zwei Hypothesen von Avogadro (1811). [PDF]. Entnommen aus: bibnum.education.fr
- Nuria Martínez Medina. (5. Juli 2012). Avogadro, der große italienische Wissenschaftler des 19. Jahrhunderts. Entnommen aus: rtve.es
- Muñoz R. und Bertomeu Sánchez J.R. (2003) Die Geschichte der Wissenschaft in Lehrbüchern: Avogadros Hypothese (n), Teaching Science, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1. Februar 2018). Was ist das Avogadro-Gesetz? Entnommen aus :oughtco.com
- Die Herausgeber der Encyclopaedia Britannica. (2016, 26. Oktober). Avogadros Gesetz. Encyclopædia Britannica. Entnommen aus: britannica.com
- Yang, S. P. (2002). Haushaltsprodukte, die verwendet werden, um geschlossene Behälter zusammenzubrechen und das Avogadro-Gesetz zu demonstrieren. Chem. Pädagoge. Band: 7, Seiten: 37-39.
- Glasstone, S. (1968). Vertrag über physikalische Chemie. zweigibt Ed. Editorial Aguilar.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.