
Struktur, Eigenschaften, Risiken und Verwendungen von Natriumcyanid (NaCN)

Das Natriumcyanid ist ein anorganisches Salz, das durch ein Natriumkation Na gebildet wird+ und ein Cyanidanion CN-. Seine chemische Formel lautet NaCN. Es ist auch als Natriumcyanid bekannt und ein weißer kristalliner Feststoff. Es ist hygroskopisch, dh es absorbiert Wasser aus der Umgebung und seine Kristalle sind kubisch wie Natriumchlorid NaCl.
Wenn es in Wasser gelöst wird, neigt es dazu, Cyanwasserstoff HCN zu bilden. Seine Lösungen lösen Gold und Silber leicht auf. Aufgrund dieser Eigenschaft wird Gold und Silber aus seinen Mineralien gewonnen. Die zu diesem Zweck verwendeten Lösungen werden recycelt, dh mehrmals wiederverwendet.

Ein Teil des Cyanids kann jedoch in bestimmte Abfallteiche gelangen, was eine Gefahr für die Tierwelt und den Menschen darstellt, da Cyanid sehr giftig ist und zum Tod führen kann..
NaCN wird in der chemischen Industrie als Zwischenprodukt zur Herstellung verschiedener Arten von Verbindungen wie Farbstoffen, Agrarchemikalien sowie Arzneimitteln oder Arzneimitteln verwendet..
Natriumcyanid ist eine sehr gefährliche Verbindung, da es zum Tod führen kann. Daher muss es mit äußerster Vorsicht behandelt werden.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Flammpunkt
- 3.6 Dichte
- 3.7 Löslichkeit
- 3.8 Dissoziationskonstante
- 3,9 pH
- 3.10 Chemische Eigenschaften
- 4 Risiken
- 5 Erhalten
- 6 Verwendungen
- 6.1 Bei der Gewinnung von Gold- und Silbermineralien. Folgen
- 6.2 Bei der Herstellung anderer chemischer Verbindungen
- 6.3 In der Metallindustrie
- 6.4 Bei anderen Verwendungen
- 6.5 Nicht verwendete, in Frage gestellte oder sehr seltene Anwendungen
- 7 Referenzen
Struktur
Natriumcyanid besteht aus einem Na + -Ion und einem CN-Ion-.
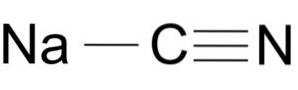
Das Cyanidion hat ein Kohlenstoffatom C und ein Stickstoffatom N, die durch eine Dreifachbindung miteinander verbunden sind..
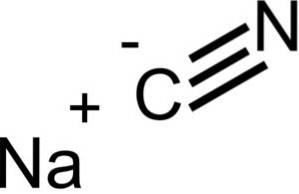
NaCN hat die gleiche Kristallstruktur wie NaCl, daher sind seine Kristalle kubisch.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Eigenschaften
Körperlicher Status
Hygroskopischer weißer kristalliner Feststoff (absorbiert Wasser aus der Umwelt).
Molekulargewicht
49,007 g / mol
Schmelzpunkt
563,7 ºC
Siedepunkt
1496 ºC
Flammpunkt
Es ist nicht brennbar. Bei einem Brand entstehen jedoch HCN-Cyanwasserstoff und Stickoxide..
Dichte
1,595 g / cm3 bei 20 ºC
Löslichkeit
In Wasser sehr gut löslich: 48 g / 100 ml bei 10 ° C, 82 g / 100 ml bei 35 ° C. In Alkohol schwer löslich
Dissoziationskonstante
Es wird in wässriger Lösung unter Bildung von Cyanwasserstoff-HCN hydrolysiert. Die Konstante dieser Hydrolyse ist K.h = 2,5 x 10-5.
pH
Wässrige NaCN-Lösungen sind stark alkalisch
Chemische Eigenschaften
Wenn es in Wasser gelöst wird, trennt es sich in seine Na-Ionen+ und CN-. In wässriger Lösung das Cyanidion CN- nimm ein Proton H.+ Wasser H.zweiOder HCN und ein OH-Ion bilden-, so wird die Lösung alkalisch.
CN- + H.zweiO → HCN + OH-
Aus diesem Grund zersetzen sich seine wässrigen Lösungen bei Lagerung schnell und bilden Cyanwasserstoff-HCN..
Es ist ätzend gegenüber Aluminium. Seine Lösungen lösen Gold-Au und Silber-Ag in Gegenwart von Luft leicht auf..
Es ist ein Chelatbildner seit dem Cyanidanion CN- kann leicht an andere Metalle wie Silber, Gold, Quecksilber, Zink, Cadmium usw. binden..
Hat einen schwachen bitteren Mandelgeruch.
Risiken
Es muss mit großer Sorgfalt behandelt werden. Es ist eine hochgiftige Verbindung, hemmt wichtige Stoffwechselprozesse und führt durch Verschlucken, Einatmen, Absorption durch die Haut oder Kontakt mit den Augen zum Tod..
Beim Einatmen löst sich NaCN in der Schleimhaut der Atemwege auf und gelangt in den Blutkreislauf. Das Cyanidion von NaCN hat eine starke Affinität zu Eisen in der Oxidationsstufe von +3, dh dem Eisen (III) -Kation Fe3+.
Wenn Cyanid absorbiert wird, reagiert es schnell mit Fe3+ eines wichtigen Enzyms der Mitochondrien der Zellen (Cytochromoxidase), wodurch bestimmte Prozesse der Atmung davon verhindert werden.
Daher wird die Zellatmung gehemmt oder verlangsamt und es kommt zu einer zytotoxischen Hypoxie. Dies bedeutet, dass Zellen und Gewebe keinen Sauerstoff verbrauchen können, insbesondere Gehirn- und Herzzellen.
Auf diese Weise kommt es zu dauerhaften oder tödlichen Schäden am Körper. Dies kann sowohl bei Menschen als auch bei Tieren auftreten..
Wenn es eingenommen wird, verursacht es zusätzlich zu den oben genannten eine Verstopfung der Blutgefäße und eine Korrosion der Magenschleimhaut.

Es ist nicht brennbar, setzt jedoch bei Kontakt mit Säuren HCN frei, das leicht entflammbar und giftig ist.
Wenn es mit Nitriten oder Chloraten schmilzt, kann es explodieren.
Erhalten
Kann mit Natrium Na, Ammoniak NH erhalten werden3 und Kohlenstoff C. Natrium reagiert mit Ammoniak, um Natriumamid NaNH zu ergebenzwei::
2 Na + 2 NH3 → 2 NaNHzwei + H.zwei↑
Natriumamid wird mit Holzkohle auf 600 ° C erhitzt und erzeugt Natriumcyanamid NazweiNCN, das dann mit Holzkohle bei 800 ºC in Natriumcyanid umgewandelt wird:
2 NaNHzwei + C → 2 H.zwei↑ + NazweiNCN
N / AzweiNCN + C → 2 NaCN
Ein anderes Verfahren besteht darin, Calciumcyanamid CaNCN und Kohlenstoff C mit Natriumcarbonat Na zu schmelzenzweiCO3::
CaNCN + C + NazweiCO3 → CaCO3 + 2 NaCN
Es kann auch durch Durchleiten von Stickstoffgas N hergestellt werdenzwei durch eine heiße Mischung von Natriumcarbonat NazweiCO3 und pulverförmiger Kohlenstoff C unter Verwendung von Eisen Fe als Katalysator oder Reaktionsbeschleuniger:
N / AzweiCO3 + 4 C + N.zwei → 2 NaCN + 3 CO ↑
Anwendungen
Bei der Gewinnung von Gold- und Silbermineralien. Folgen
Natriumcyanid wird seit langem verwendet, um die Metalle Gold und Silber aus ihren Erzen zu gewinnen..
Das dabei verwendete Cyanid wird recycelt, aber etwas entweicht zusammen mit den nicht zurückgewonnenen Schwermetallen in den Abfallteich.
Vögel, Fledermäuse und andere Tiere, die aus diesen Zyanidlagunen trinken, wurden vergiftet.
Es gibt Aufzeichnungen über einen Damm in Rumänien, der einen Abfallteich isoliert und durch ein Wetterereignis beschädigt wurde..
Infolgedessen wurden Tonnen von Cyanid in den Sasar-Fluss und in nahe gelegene Grundwassersysteme wie die Flüsse Lapus, Somes und Theiß freigesetzt, die in der Donau endeten..
Dies verursachte eine Kaskade von Tiertoten oder mit anderen Worten eine ökologische Katastrophe..

Bei der Herstellung anderer chemischer Verbindungen
NaCN-Natriumcyanid wird zur Synthese verschiedener Arten organischer Verbindungen verwendet.
Beispielsweise werden Pigmente und Farbstoffe (einschließlich optischer Aufheller), Verbindungen zur Verwendung in der Landwirtschaft oder in Agrochemikalien und verschiedene Pharmazeutika hergestellt..
Es wird auch verwendet, um Chelatbildner oder Sequestrierungsmittel für Metallionen zu erhalten..
Als Nitrile bezeichnete Verbindungen werden mit Natriumcyanid NaCN hergestellt, das bei Behandlung mit heißer saurer oder alkalischer wässriger Lösung die Gewinnung von Carbonsäuren ermöglicht.
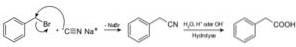
Es ermöglicht die Herstellung von Fettsäuren mit Cyanogruppen, Schwermetallcyaniden und Blausäure oder HCN-Cyanwasserstoff.
In der Metallindustrie
NaCN wird in Lösungen verwendet, die beim Galvanisieren oder Galvanisieren von Metallen (Beschichten von Metallen mit anderen), beispielsweise Zink, verwendet werden.
Es ist ein Bestandteil von gehärtetem Stahl. Dient auch zur Metallreinigung.
Bei anderen Verwendungszwecken
Natriumcyanid ist ein Zwischenprodukt bei der Herstellung von Nylon.
Dient zur Trennung von Mineralien durch Schaumflotation.
Anwendungen nicht mehr verwendet, in Frage gestellt oder sehr selten
NaCN wurde verwendet, um Nagetiere wie Kaninchen und Ratten und ihre Höhlen zu töten und Termitennester zu töten.
Derzeit wird es gelegentlich verwendet, um Kojoten, Füchse und Wildhunde zu eliminieren. Wird in Kapselform als Einzel- oder Mehrfachdosis auf Weideland, Jagdgebieten und Wäldern verwendet.
Aufgrund seiner extremen Toxizität sollte NaCN nur von geschulten Personen angewendet werden..
Diese Verwendung wird als sehr gefährlich für den Menschen angesehen, aber es gibt diejenigen, die sie noch verwenden.

In der Landwirtschaft wurde es früher zur Begasung von Zitrusfruchtbäumen und anderen Früchten verwendet. Es wurde auch als Insektizid und Mitizid (Milbeneliminator) verwendet, das nach der Ernte, für nicht gelagerte Zitrusfrüchte oder zur Begasung von Lastwagen, mit denen sie transportiert wurden, angewendet wurde. Es wurde auch verwendet, um Schiffe, Eisenbahnwaggons und Lagerhäuser zu begasen..
Alle diese Verwendungen wurden aufgrund der hohen Toxizität von Natriumcyanid in Frage gestellt. Aus diesem Grund wird es nicht mehr oder nur noch sehr selten und unter sehr kontrollierten Bedingungen verwendet..
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Natriumcyanid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Sons.
- Hurst, H.E. und Martin, M.D. (2017). Toxikologie. Zyanid. In Pharmakologie und Therapeutika für die Zahnmedizin (Siebte Ausgabe). Von sciencedirect.com wiederhergestellt.
- Coppock, R.W. und Dziwenka, M. (2015). Bedrohung der Tierwelt durch chemische Kampfstoffe. Im Handbuch der Toxikologie chemischer Kampfstoffe (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Morrison, R.T. und Boyd, R.N. (2002). Organische Chemie. 6. Auflage. Prentice-Hall.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.