
Ammoniumhydroxidstruktur, Eigenschaften und Verwendungen
Das Ammoniumhydroxid ist eine Verbindung mit der Summenformel NH4Oh oh5NO, das durch Auflösen von Ammoniakgas (NH) erzeugt wird3) im Wasser. Aus diesem Grund wird es Ammoniakwasser oder flüssiges Ammoniak genannt..
Es ist eine farblose Flüssigkeit mit einem sehr intensiven und scharfen Geruch, die nicht isolierbar ist. Diese Eigenschaften stehen in direktem Zusammenhang mit der NH-Konzentration3 in Wasser gelöst; Konzentration, die in der Tat als Gas große Mengen davon umfassen kann, die in einem kleinen Wasservolumen gelöst sind.
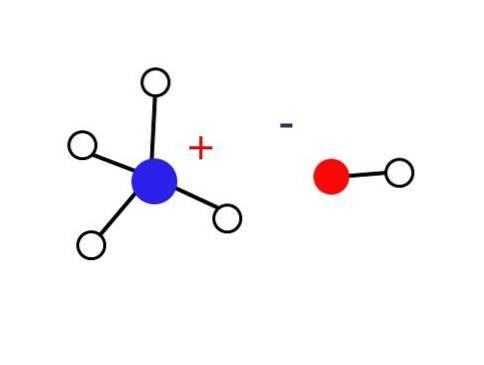
Ein beträchtlich kleiner Teil dieser wässrigen Lösungen besteht aus NH-Kationen.4+ und die OH-Anionen-. Andererseits kann in sehr verdünnten Lösungen oder in gefrorenen Feststoffen bei sehr niedrigen Temperaturen Ammoniak in Form von Hydraten wie NH gefunden werden3∙ H.zweiOder 2NH3∙ H.zweiO und NH3H 2HzweiODER.
Als merkwürdige Tatsache bestehen Jupiters Wolken aus verdünnten Lösungen von Ammoniumhydroxid. Die Galileo-Raumsonde konnte jedoch kein Wasser in den Wolken des Planeten finden, was aufgrund des Wissens über die Bildung von Ammoniumhydroxid zu erwarten wäre. das heißt, sie sind NH-Kristalle4OH völlig wasserfrei.
Das Ammoniumion (NH4+) wird im tubulären Nierenlumen durch die Vereinigung von Ammoniak und Wasserstoff erzeugt, die von den tubulären Nierenzellen ausgeschieden werden. Ebenso wird Ammoniak in Nierentubuluszellen bei der Umwandlung von Glutamin in Glutamat und damit bei der Umwandlung von Glutamat in α-Ketoglutarat erzeugt.
Ammoniak wird industriell nach der Haber-Bosch-Methode hergestellt, bei der Stickstoff- und Wasserstoffgase umgesetzt werden. unter Verwendung von Eisenionen, Aluminiumoxid und Kaliumoxid als Katalysatoren. Die Reaktion wird bei hohen Drücken (150 - 300 Atmosphären) und hohen Temperaturen (400 - 500 ºC) mit einer Ausbeute von 10 - 20% durchgeführt.
Bei der Reaktion entsteht Ammoniak, das bei Oxidation Nitrite und Nitrate erzeugt. Diese sind für die Gewinnung von Salpetersäure und Düngemitteln wie Ammoniumnitrat unerlässlich..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Ammoniak-Eis
- 2 Physikalische und chemische Eigenschaften
- 2.1 Summenformel
- 2.2 Molekulargewicht
- 2.3 Aussehen
- 2.4 Konzentration
- 2.5 Geruch
- 2.6 Geschmack
- 2.7 Schwellenwert
- 2.8 Siedepunkt
- 2.9 Löslichkeit
- 2.10 Löslichkeit in Wasser
- 2.11 Dichte
- 2.12 Dampfdichte
- 2.13 Dampfdruck
- 2.14 Ätzende Wirkung
- 2,15 pH
- 2.16 Dissoziationskonstante
- 3 Nomenklatur
- 4 Löslichkeit
- 5 Risiken
- 5.1 Reaktivität
- 6 Verwendungen
- 6.1 In Lebensmitteln
- 6.2 Therapeutika
- 6.3 Industrie und Sonstiges
- 6.4 In der Landwirtschaft
- 7 Referenzen
Chemische Struktur
Wie aus der Definition hervorgeht, besteht Ammoniumhydroxid aus einer wässrigen Lösung von Ammoniakgas. Daher gibt es in der Flüssigkeit keine andere definierte Struktur als die einer zufälligen Anordnung von NH-Ionen.4+ und OH- durch Wassermoleküle solvatisiert.
Ammonium- und Hydroxylionen sind Produkte eines Gleichgewichts der Ammoniakhydrolyse, daher ist es üblich, dass diese Lösungen einen stechenden Geruch haben:
NH3(g) + H.zweiO (l) <=> NH4+(ac) + OH-(ac)
Gemäß der chemischen Gleichung würde eine starke Abnahme der Wasserkonzentration das Gleichgewicht zur Bildung von mehr Ammoniak verschieben; Das heißt, wenn das Ammoniumhydroxid erhitzt wird, werden Ammoniakdämpfe freigesetzt.
Aus diesem Grund NH-Ionen4+ und OH- unter terrestrischen Bedingungen keinen Kristall bilden, was zur festen Base NH führt4Oh, existiere nicht.
Der Feststoff sollte nur aus elektrostatisch wechselwirkenden Ionen bestehen (wie im Bild gezeigt)..
Ammoniak-Eis
Bei Temperaturen weit unter 0 ° C und umgeben von enormen Drücken, wie sie in den Kernen von eisigen Monden herrschen, gefrieren Ammoniak und Wasser. Dabei kristallisieren sie zu einer festen Mischung mit verschiedenen stöchiometrischen Verhältnissen, wobei NH am einfachsten ist3∙ H.zweiO: Ammoniakmonohydrat.
NH3∙ H.zweiO und NH3H 2HzweiOder es handelt sich um Ammoniak-Eis, da der Feststoff aus einer kristallinen Anordnung von Wasser- und Ammoniakmolekülen besteht, die durch Wasserstoffbrücken verbunden sind..
Bei einer Änderung von T und P tritt nach Berechnungsstudien, die alle physikalischen Variablen und ihre Auswirkungen auf diese Eisarten simulieren, ein Übergang einer NH-Phase auf.3∙ nHzweiOder zu einer NH-Phase4Oh.
Daher tritt NH nur unter diesen extremen Bedingungen auf4OH kann als Produkt einer Protonierung innerhalb des Eises zwischen NH existieren3 und der H.zweiODER:
NH3(s) + H.zweiSie) <=> NH4Oh s)
Beachten Sie, dass sich die beteiligten Spezies diesmal im Gegensatz zur Ammoniakhydrolyse in einer festen Phase befinden. Ein Ammoniak-Eis, das ohne Freisetzung von Ammoniak salzig wird.
Physikalische und chemische Eigenschaften
Molekularformel
NH4Oh oh5NICHT
Molekulargewicht
35,046 g / mol
Aussehen
Es ist eine farblose Flüssigkeit.
Konzentration
Bis zu ca. 30% (für NH-Ionen4+ und OH-).
Geruch
Sehr stark und scharf.
Geschmack
Acre.
Schwellwert
34 ppm für unspezifischen Nachweis.
Siedepunkt
38 ºC (25%).
Löslichkeit
Existiert nur in wässriger Lösung.
Wasserlöslichkeit
In unbegrenzten Anteilen mischbar.
Dichte
0,90 g / cm3 bei 25 ºC.
Wasserdampfdichte
Bezogen auf Luft als Einheit: 0,6. Das heißt, es ist weniger dicht als Luft. Logischerweise bezieht sich der angegebene Wert jedoch auf Ammoniak als Gas, nicht auf seine wässrigen Lösungen oder NH4Oh.
Dampfdruck
2.160 mmHg bei 25 ºC.
Ätzende Wirkung
Es ist in der Lage, Zink und Kupfer aufzulösen.
pH
11,6 (1 N Lösung); 11,1 (Lösung 0,1 N.) und 10,6 (0,01 N Lösung).
Dissoziationskonstante
pKb = 4,767; Kb = 1,71 · 10-5 bei 20 ºC
pKb = 4,751; Kb = 1.774 · 10-5 bei 25ºC.
Durch fast unmerkliches Erhöhen der Temperatur wird die Basizität von Ammoniumhydroxid erhöht.
Nomenklatur
Was sind alle gebräuchlichen und offiziellen Namen, die NH erhält?4OH? Nach Angaben der IUPAC lautet ihr Name Ammoniumhydroxid, da es das Hydroxylanion enthält.
Ammonium ist aufgrund seiner +1 Ladung einwertig, daher wird es unter Verwendung der Stock-Nomenklatur wie folgt benannt: Ammoniumhydroxid (I).
Obwohl die Verwendung des Begriffs Ammoniumhydroxid technisch falsch ist, da die Verbindung nicht isolierbar ist (zumindest nicht auf der Erde, wie im ersten Abschnitt ausführlich erläutert)..
Ammoniumhydroxid wird auch als Ammoniakwasser und flüssiges Ammoniak bezeichnet..
Löslichkeit
NH4OH existiert unter terrestrischen Bedingungen nicht als Salz, es kann nicht abgeschätzt werden, wie löslich es in verschiedenen Lösungsmitteln ist.
Es wäre jedoch zu erwarten, dass es in Wasser extrem löslich ist, da seine Auflösung enorme Mengen an NH freisetzen würde3. Theoretisch wäre es eine erstaunliche Möglichkeit, Ammoniak zu speichern und zu transportieren.
In anderen Lösungsmitteln, die Wasserstoffbrückenbindungen aufnehmen können, wie Alkoholen und Aminen, ist zu erwarten, dass sie auch in ihnen sehr gut löslich sind. Hier das NH-Kation4+ ist ein Wasserstoffbrückendonor und OH- fungiert als beides.
Beispiele für diese Wechselwirkungen mit Methanol wären: H.3N.+-H - OHCH3 und HO- - HOCH3 (OHCH3 zeigt an, dass Sauerstoff die Wasserstoffbindung erhält, nicht dass die Methylgruppe an H gebunden ist).
Risiken
-Bei Kontakt mit den Augen kommt es zu Reizungen, die zu Augenschäden führen können..
-Es ist ätzend. Daher kann es bei Hautkontakt zu Reizungen und bei hohen Konzentrationen des Reagenzes zu Hautverbrennungen kommen. Wiederholter Kontakt von Ammoniumhydroxid mit der Haut kann dazu führen, dass sie trocken, juckend und rot ist (Dermatitis)..
-Das Einatmen von Ammoniumhydroxidnebel kann zu einer akuten Reizung der Atemwege führen, die durch Ersticken, Husten oder Atemnot gekennzeichnet ist. Eine längere oder wiederholte Exposition gegenüber der Substanz kann zu wiederkehrenden Bronchialinfektionen führen. Auch das Einatmen von Ammoniumhydroxid kann zu Reizungen der Lunge führen..
-Die Exposition gegenüber hohen Konzentrationen von Ammoniumhydroxid kann einen medizinischen Notfall darstellen, da sich in der Lunge Flüssigkeit ansammeln kann (Lungenödem)..
-Die Konzentration von 25 ppm wurde als Expositionsgrenze in einer 8-stündigen Arbeitsschicht in einer Umgebung festgelegt, in der der Arbeiter der schädlichen Wirkung von Ammoniumhydroxid ausgesetzt ist.
Reaktivität
-Neben der möglichen Gesundheitsschädigung durch Einwirkung von Ammoniumhydroxid gibt es weitere Vorsichtsmaßnahmen, die bei der Arbeit mit dem Stoff berücksichtigt werden müssen..
-Ammoniumhydroxid kann mit vielen Metallen wie Silber, Kupfer, Blei und Zink reagieren. Es reagiert auch mit den Salzen dieser Metalle unter Bildung explosiver Verbindungen und setzt Wasserstoffgas frei; was wiederum brennbar und explosiv ist.
-Es kann heftig mit starken Säuren reagieren, zum Beispiel: Salzsäure, Schwefelsäure und Salpetersäure. In gleicher Weise reagiert es auch mit Dimethylsulfat und Halogenen..
-Reagiert mit starken Basen wie Natriumhydroxid und Kaliumhydroxid unter Bildung von Ammoniakgas. Dies kann durch Beobachtung des Gleichgewichts in Lösung überprüft werden, in dem die Zugabe von OH-Ionen erfolgt- verschiebt das Gleichgewicht zur NH-Bildung3.
-Kupfer- und Aluminiummetalle sowie andere verzinkte Metalle sollten wegen ihrer korrosiven Wirkung auf Ammoniumhydroxid nicht verwendet werden..
Anwendungen
Im Essen
-Es wird als Zusatzstoff in vielen Lebensmitteln verwendet, in denen es als Treibmittel, pH-Kontroll- und Veredelungsmittel für die Oberfläche von Lebensmitteln wirkt..
-Die Liste der Lebensmittel, in denen Ammoniumhydroxid verwendet wird, ist umfangreich und umfasst Backwaren, Käse, Pralinen, Süßigkeiten und Pudding..
-Ammoniumhydroxid wird von der FDA als sicherer Stoff für die Lebensmittelverarbeitung eingestuft, sofern die festgelegten Standards eingehalten werden..
-In Fleischprodukten wird es als antimikrobielles Mittel verwendet, um Bakterien wie E. coli zu eliminieren und auf nicht nachweisbare Werte zu reduzieren. Die Bakterien befinden sich im Darm von Rindern und passen sich der sauren Umgebung an. Ammoniumhydroxid hemmt durch Regulierung des pH-Werts das Bakterienwachstum.
Therapeutika
-Ammoniumhydroxid hat mehrere therapeutische Anwendungen, einschließlich:
-Die 10% ige Lösung wird als Stimulans des Atemreflexes verwendet
-Äußerlich wird es auf der Haut zur Behandlung von Insektenstichen und -stichen verwendet. Es wirkt im Verdauungssystem als Antazida und Karminativum, dh es hilft, Gase zu eliminieren.
Darüber hinaus wird es als topisches Mittel gegen akute und chronische Schmerzen des Bewegungsapparates eingesetzt. Infolge der rubefacient Wirkung von Ammoniumhydroxid kommt es zu einer lokalen Zunahme des Blutflusses, der Rötung und der Reizung..
Industrie und Sonstiges
-Es reduziert NOx (hochreaktive Gase wie Stickoxid (NO) und Stickstoffdioxid (NO))zwei)) für Batterieemissionen und NOx-Reduzierung der Stack-Emissionen.
-Es wird als Weichmacher verwendet; Farbzusatz und zur Oberflächenbehandlung.
-Erhöht die Porosität des Haares, wodurch die Pigmente des Farbstoffs eine größere Penetration aufweisen, wodurch ein besseres Finish erzielt wird.
-Ammoniumhydroxid wird als antimikrobielles Mittel bei der Abwasserbehandlung eingesetzt. Darüber hinaus ist es an der Synthese von Chloramin beteiligt. Diese Substanz erfüllt eine ähnliche Funktion wie Chlor bei der Reinigung von Schwimmbadwasser und hat den Vorteil, dass sie weniger toxisch ist.
-Es wird als Korrosionsinhibitor bei der Erdölraffination eingesetzt.
-Es wird als Reinigungsmittel in verschiedenen Industrie- und Handelsprodukten verwendet und auf verschiedenen Oberflächen verwendet, darunter: Edelstahl, Porzellan, Glas und Ofen.
-Darüber hinaus wird es zur Herstellung von Waschmitteln, Seifen, Pharmazeutika und Tinten verwendet..
In der Landwirtschaft
Obwohl Ammoniumhydroxid nicht direkt als Dünger verabreicht wird, erfüllt es diese Funktion. Ammoniak wird nach der Haber-Bosch-Methode aus Luftstickstoff hergestellt und unter seinem Siedepunkt (-33 ºC) gekühlt zu den Einsatzorten transportiert.
Das unter Druck stehende Ammoniak wird als Dampf in den Boden injiziert, wo es sofort mit dem edaphischen Wasser reagiert und in Form von Ammonium (NH) übergeht4+), das an den Kationenaustauschstellen des Bodens zurückgehalten wird. Zusätzlich wird Ammoniumhydroxid erzeugt. Diese Verbindungen sind eine Stickstoffquelle.
Stickstoff bildet zusammen mit Phosphor und Kalium die Triade der wichtigsten pflanzlichen Nährstoffe, die für ihr Wachstum wesentlich sind..
Verweise
- Ganong, W. F. (2002), Medical Physiology. 19. Ausgabe. Modernes Handbuch Editorial.
- A. D. Fortes, J. P. Brodholt, I. G. Wood und L. Vocadlo. (2001). Ab-initio-Simulation von Ammoniakmonohydrat (NH3∙ H.zweiO) und Ammoniumhydroxid (NH4OH). Amerikanisches Institut für Physik. J. Chem. Phys., Bd. 115, Nr. 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6. Februar 2017). Ammoniumhydroxid Fakten. Wiederhergestellt von :oughtco.com
- Pochteca-Gruppe. (2015). Ammoniumhydroxid. pochteca.com.mx
- NJ Gesundheit. (s.f.). Datenblatt zu gefährlichen Substanzen: Ammoniumhydroxid. [PDF]. Wiederhergestellt von: nj.gov
- Chemielerner. (2018). Ammoniumhydroxid. Wiederhergestellt von: chemistrylearner.com
- PubChem. (2018). Ammoniumhydroxid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.