
Hexokinase Strukturen, Funktionen, Formen

Das Hexokinase (HK) ist das Enzym, das die erste Reaktion des glykolytischen Weges in praktisch allen lebenden Organismen, sowohl Prokaryoten als auch Eukaryoten, katalysiert. Es ist für die Übertragung einer Phosphorylgruppe auf Glucose verantwortlich und produziert Glucose-6P, obwohl es auch andere Zuckerhexosen (6 Kohlenstoffatome) phosphorylieren kann..
Dieses Enzym wird in eine der beiden Familien von Glukosekinaseenzymen (Enzyme, die Phosphorylgruppen auf Substrate wie Glukose übertragen) eingeteilt: die Hexokinase (HK) -Familie, deren Mitglieder in drei verschiedene Gruppen unterteilt sind, die als HK-Gruppe, die Gruppe, bekannt sind A und Gruppe B..
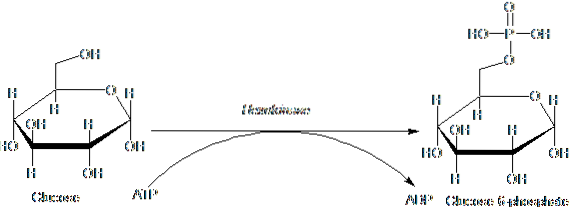
Die zur HK-Familie gehörenden Enzyme sind durch Phosphorylierung von Glucose auf Kosten von ATP als Donormolekül der Phosphorylgruppe gekennzeichnet, und ihre Mitglieder unterscheiden sich untereinander hauptsächlich hinsichtlich ihres Molekulargewichts und ihrer Substratspezifität..
Die HK-Gruppe umfasst die Enzyme von eukaryotischen Organismen (ATP: D-Hexose-6-Phosphotransferasen), während die Gruppe A durch die Enzyme von gramnegativen Bakterien, Cyanobakterien, amitochondrialen Protisten und Trypanosomatiden repräsentiert wird und die Gruppe B die Enzyme grampositiv enthält Bakterien und krenoqueotische Organismen.
Enzyme der Gruppen A und B sind auch als Glucokinasen (GlcKs) bekannt, da sie ausschließlich Glucose phosphorylieren können, weshalb diese Enzyme ATP: D-Glucose-6-Phosphotransferasen genannt werden.
Als glykolytisches Enzym hat Hexokinase eine große metabolische Bedeutung, da ohne sie dieser wichtige Weg nicht möglich wäre und Zellen, die stark vom Kohlenhydratverbrauch abhängig sind, wie Gehirn- und Muskelzellen vieler Säugetiere, im Allgemeinen schwerwiegende funktionelle und physiologische Hindernisse aufweisen würden.
Artikelverzeichnis
- 1 Struktur
- 2 Funktionen
- 2.1 In Pflanzen
- 3 Formen
- 4 Referenzen
Struktur
Wie später zu sehen sein wird, existieren verschiedene Arten von Hexokinaseenzymen in Säugetieren und anderen Wirbeltieren (sowie in einzelligen Organismen wie Hefe). Bei Säugetieren wurden vier beschrieben: Isoformen I, II, III und IV.
Die ersten drei Isozyme haben ein Molekulargewicht von 100 kDa, aber Isozym IV hat 50 kDa. Diese Isoenzyme (insbesondere I-III) zeigen eine hohe Sequenzähnlichkeit zwischen ihnen in Bezug auf ihre C- und N-Termini sowie mit anderen Mitgliedern der Hexokinase-Familie..
Die N-terminale Domäne dieser Enzyme wird als "regulatorische" Domäne angesehen, während die katalytische Aktivität von der C-terminalen Domäne ausgeführt wird (Säugetier-HK II hat aktive Stellen in beiden Domänen)..
Die N-terminale Domäne ist über eine Alpha-Helix mit der C-terminalen Domäne verbunden, jedes hat ein Molekulargewicht von ungefähr 50 kDa und eine Bindungsstelle für Glucose.
Die Tertiärstruktur dieser Enzyme besteht im wesentlichen aus β-gefalteten Schichten, die mit Alpha-Helices gemischt sind, deren Anteil in Bezug auf das Enzym und die betreffende Spezies variiert; Die Bindungsstelle für ATP, das andere Substrat für Hexokinase, besteht üblicherweise aus fünf β-Faltblättern und zwei Alpha-Helices.
Eigenschaften
Hexokinase hat eine transzendentale Funktion im Kohlenhydratstoffwechsel der meisten Lebewesen, da sie den ersten Schritt des glykolytischen Weges katalysiert und die Phosphorylierung von Glukose in der Zelle vermittelt..
Dieser erste Schritt der Glykolyse, der aus der Übertragung einer Phosphorylgruppe von ATP (Donor) auf Glucose unter Bildung von Glucose-6-phosphat und ADP besteht, ist der erste der beiden Energieinvestitionsschritte in Form von ATP.
Darüber hinaus ist die durch Hexokinase katalysierte Reaktion der Schritt der "Aktivierung" von Glucose für ihre anschließende Verarbeitung und stellt einen Schritt der "Bindung" dar, da die so phosphorylierte Glucose die Zelle mittels ihrer herkömmlichen Transporter in der Membran nicht verlassen kann.
Das durch Hexokinase katalysierte Reaktionsprodukt, dh Glucose-6-phosphat, ist ein Verzweigungspunkt, da es das erste Substrat ist, das im Pentosephosphatweg und bei der Synthese von Glykogen bei vielen Tieren (und der Stärke in Pflanzen) verwendet wird..
In den Pflanzen
Die Funktion der Hexokinase in Pflanzen unterscheidet sich nicht sehr von der von Tieren oder Mikroorganismen. In höheren Pflanzen fungiert dieses Enzym jedoch auch als "Sensor" für die Zuckerkonzentration..
Die Bedeutung dieser Funktion in diesen Organismen hängt mit der Beteiligung von Zuckern als regulatorische Faktoren bei der Expression von Genen zusammen, die an verschiedenen Stoffwechselprozessen beteiligt sind, wie z.
- Photosynthese
- Der Glyoxylatzyklus
- Das Atmen
- Der Abbau oder die Synthese von Stärke und Saccharose
- Stickstoffstoffwechsel
- Abwehr gegen Krankheitserreger
- Regulation des Zellzyklus
- Die Heilungsreaktion
- Pigmentierung
- Seneszenz unter anderem.
Diese Funktion der Hexokinase als "Sensor" für die Menge an intrazellulärer Glucose wurde auch für Hefen und Säugetiere beschrieben..
Formen
In der Natur gibt es verschiedene Formen von Hexokinasen, und dies hängt im Wesentlichen von der betrachteten Art ab.
Beispielsweise wurde bei Menschen und anderen Wirbeltieren die Existenz von 4 verschiedenen Isoformen des Hexokinaseenzyms im cytosolischen Kompartiment nachgewiesen, die mit den römischen Ziffern I, II, III und IV bezeichnet wurden.
Die Isoenzyme I, II und III haben ein Molekulargewicht von 100 kDa, werden durch ihr Reaktionsprodukt (Glucose-6-phosphat) gehemmt und sind sehr glucosebezogen, dh sie haben eine sehr niedrige Km-Konstante. Diese Enzyme weisen jedoch eine schlechte Substratspezifität auf und können andere Hexosen wie Fructose und Mannose phosphorylieren.
Isoenzym IV, auch bekannt als Glucokinase (GlcK), hat nur ein Molekulargewicht von 50 kDa und trotz seiner geringen Verwandtschaft (hohe Km-Werte) eine hohe Spezifität für Glucose als Substrat und ist diesen nicht ausgesetzt. Regulationsmechanismen als die anderen drei Isoenzyme.
Glukokinase (Isoenzym IV der Hexokinase vieler Säugetiere) kommt hauptsächlich in der Leber vor und hilft diesem Organ bei der „Anpassung“ seiner Glukoseverbrauchsrate als Reaktion auf Variationen dieses Substrats im zirkulierenden Blut..
Die drei Gene, die für Hexokinasen I, II und III in Tieren kodieren, scheinen denselben 50 kDa-Vorfahren zu haben, der im Genom dupliziert und fusioniert wurde, was offensichtlich erscheint, wenn beobachtet wird, dass die katalytische Aktivität der Formen I und III nur bei liegt das C-terminale Ende.
Verweise
- S. L. Aronoff, K. Berkowitz, B. Shreiner & L. Want (2004). Glukosestoffwechsel und -regulation: jenseits von Insulin und Glukagon. Diabetes-Spektrum, 17(3), 183 & ndash; 190.
- Harrington, G. N. & Bush, D. R. (2003). Die bifunktionelle Rolle der Hexokinase im Stoffwechsel und in der Glukosesignalisierung. Die Pflanzenzelle, fünfzehn(11), 2493 & ndash; 2496.
- J. C. Jang, P. León, L. Zhou & J. Sheen (1997). Hexokinase als Zuckersensor in höheren Pflanzen. Die Pflanzenzelle, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B. & Murata, K. (2005). Hypothese: Strukturen, Evolution und Vorfahr von Glukosekinasen in der Hexokinase-Familie. Zeitschrift für Biowissenschaften und Bioingenieurwesen, 99(4), 320 & ndash; 330.
- Mathews, K. E. (1998). Van Holde. Biochemie.
- Wilson, J. E. (2003). Isozyme der Säugetierhexokinase: Struktur, subzelluläre Lokalisation und Stoffwechselfunktion. Journal of Experimental Biology, 206(12), 2049–2057.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.