
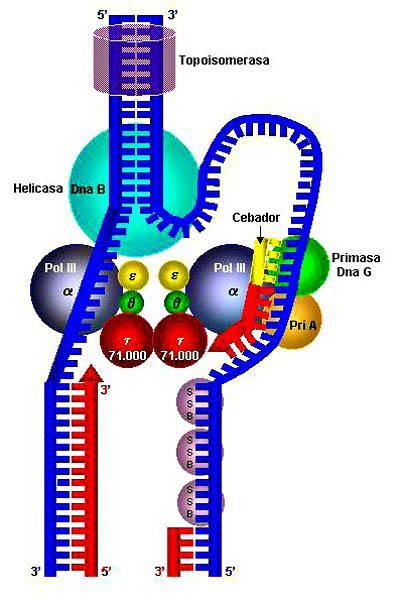
Helicasa Eigenschaften, Strukturen und Funktionen
Das Helikase bezieht sich auf eine Gruppe von Enzymen vom proteinhydrolytischen Typ, die für alle lebenden Organismen sehr wichtig sind; Sie werden auch als Motorproteine bezeichnet. Diese bewegen sich durch das Zellzytoplasma und wandeln chemische Energie durch ATP-Hydrolyse in mechanische Arbeit um..
Seine wichtigste Funktion besteht darin, die Wasserstoffbrücken zwischen den stickstoffhaltigen Basen der Nukleinsäuren aufzubrechen und so deren Replikation zu ermöglichen. Es ist wichtig zu betonen, dass Helikasen praktisch allgegenwärtig sind, da sie in Viren, Bakterien und in eukaryotischen Organismen vorhanden sind..
Das erste dieser Proteine oder Enzyme wurde 1976 in Bakterien entdeckt Escherichia coli;; Zwei Jahre später wurde die erste Helikase in einem eukaryotischen Organismus in Lilienpflanzen entdeckt.
Gegenwärtig wurden Helikase-Proteine in allen natürlichen Reichen einschließlich Viren charakterisiert, was impliziert, dass ein umfassendes Wissen über diese hydrolytischen Enzyme, ihre Funktionen in Organismen und ihre mechanistische Rolle gewonnen wurde..
Artikelverzeichnis
- 1 Funktionen
- 1.1 DNA-Helikase
- 1.2 RNA-Helikase
- 2 Taxonomie
- 2.1 SF1
- 2.2 SF2
- 2.3 SF3
- 2,4 SF4
- 2,5 SF5
- 2,6 SF6
- 3 Struktur
- 4 Funktionen
- 4.1 DNA-Helikase
- 4.2 RNA-Helikase
- 5 Medizinische Bedeutung
- 5.1 Werner-Syndrom
- 5.2 Bloom-Syndrom
- 5.3 Rothmund-Thomson-Syndrom
- 6 Referenzen
Eigenschaften
Hellicasen sind biologische oder natürliche Makromoleküle, die chemische Reaktionen (Enzyme) beschleunigen. Sie zeichnen sich hauptsächlich durch die Trennung chemischer Adenosintriphosphat (ATP) -Komplexe durch Hydrolyse aus.
Diese Enzyme verwenden ATP, um Komplexe von Desoxyribonukleinsäuren (DNA) und Ribonukleinsäuren (RNA) zu binden und umzugestalten..
Es gibt mindestens zwei Arten von Helikasen: DNA und RNA.
DNA-Helikase
DNA-Helikasen wirken bei der DNA-Replikation und sind durch die Trennung doppelsträngiger DNA in Einzelstränge gekennzeichnet.
RNA-Helikase
Diese Enzyme wirken in den Stoffwechselprozessen der Ribonukleinsäure (RNA) und in der Vermehrung, Reproduktion oder ribosomalen Biogenese.
RNA-Helikase ist auch ein Schlüssel für den Vorspleißprozess von Messenger-RNA (mRNA) und die Initiierung der Proteinsynthese nach Transkription von DNA zu RNA im Zellkern..
Taxonomie
Diese Enzyme können gemäß ihrer Aminosäuresequenzierungshomologie zur ATPase-Domäne der Kernaminosäure oder durch gemeinsame Sequenzierungsmotive differenziert werden. Entsprechend der Klassifikation werden diese in 6 Superfamilien (SF 1-6) eingeteilt:
SF1
Die Enzyme dieser Superfamilie haben eine 3'-5'- oder 5'-3'-Translokationspolarität und bilden keine Ringstrukturen..
SF2
Es ist als die größte Gruppe von Helikasen bekannt und besteht hauptsächlich aus RNA-Helikasen. Sie haben eine Translokationspolarität im Allgemeinen 3'-5 'mit sehr wenigen Ausnahmen.
Sie haben neun Motive (aus dem Englischen Motive, Dies wird übersetzt als "wiederkehrende Elemente") von hochkonservierten Aminosäuresequenzen und bildet wie SF1 keine Ringstrukturen.
SF3
Sie sind charakteristische Helikasen von Viren und haben eine einzigartige 3'-5'-Translokationspolarität. Sie besitzen nur vier hochkonservierte Sequenzmotive und bilden Ringstrukturen oder Ringe.
SF4
Sie wurden erstmals in Bakterien und Bakteriophagen beschrieben. Sie sind eine Gruppe von replizierenden oder replikativen Helikasen.
Sie haben eine einzigartige 5'-3'-Translokationspolarität und fünf hochkonservierte Sequenzmotive. Diese Helikasen zeichnen sich durch die Bildung von Ringen aus.
SF5
Sie sind Proteine vom Rho-Faktor-Typ. Die Helikasen der SF5-Superfamilie sind charakteristisch für prokaryotische Organismen und sind hexameres ATP-abhängig. Es wird angenommen, dass sie eng mit SF4 verwandt sind; Darüber hinaus haben sie ringförmige und nicht ringförmige Formen.
SF6
Es handelt sich um Proteine, die offenbar mit der SF3-Superfamilie verwandt sind. SF6s präsentieren jedoch eine Domäne von ATPase-Proteinen, die mit verschiedenen zellulären Aktivitäten (AAA-Proteinen) assoziiert sind, die in SF3 nicht vorhanden sind.
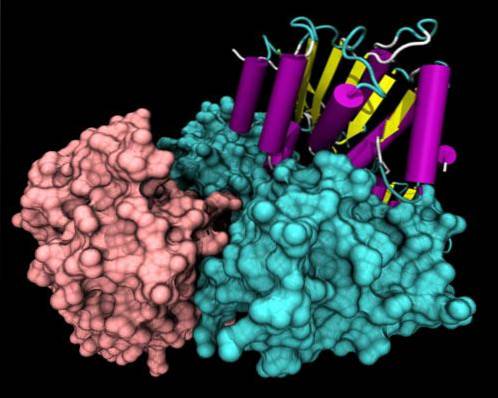
Struktur
Strukturell haben alle Helikasen im vorderen Teil ihrer Primärstruktur hochkonservierte Sequenzmotive. Ein Teil des Moleküls hat eine bestimmte Aminosäureanordnung, die von der spezifischen Funktion jeder Helikase abhängt..
Die strukturell am besten untersuchten Helikasen sind die der SF1-Superfamilie. Es ist bekannt, dass diese Proteine in 2 Domänen gruppiert sind, die den multifunktionellen RecA-Proteinen sehr ähnlich sind, und diese Domänen bilden eine ATP-Bindungstasche zwischen ihnen..
Nicht konservierte Regionen können spezifische Domänen des DNA-Erkennungstyps, der Zelllokalisierungsdomäne und des Protein-Proteins aufweisen..
Eigenschaften
DNA-Helikase
Die Funktionen dieser Proteine hängen von einer wichtigen Vielzahl von Faktoren ab, einschließlich Umweltstress, Zelllinie, genetischem Hintergrund und Zellzyklusstadien..
Es ist bekannt, dass die SF1-DNA-Helikasen spezifische Funktionen bei der Reparatur, Replikation, Übertragung und Rekombination von DNA erfüllen..
Sie trennen Stränge einer DNA-Doppelhelix und sind an der Aufrechterhaltung der Telomere, der Reparatur von Doppelstrangbrüchen und der Entfernung von Nukleinsäure-assoziierten Proteinen beteiligt.
RNA-Helikase
Wie bereits erwähnt, sind RNA-Helikasen bei der überwiegenden Mehrheit der RNA-Stoffwechselprozesse von entscheidender Bedeutung, und es ist auch bekannt, dass diese Proteine am Nachweis von viraler RNA beteiligt sind..
Darüber hinaus wirken sie in der antiviralen Immunantwort, da sie fremde RNA oder körpereigene (bei Wirbeltieren) nachweisen..
Medizinische Bedeutung
Hellicases helfen Zellen, endogenen und exogenen Stress zu überwinden, Chromosomeninstabilität zu vermeiden und das zelluläre Gleichgewicht aufrechtzuerhalten.
Das Versagen dieses Systems oder des homöostatischen Gleichgewichts hängt mit genetischen Mutationen zusammen, an denen Gene beteiligt sind, die für Proteine vom Helikase-Typ kodieren. Aus diesem Grund sind sie Gegenstand biomedizinischer und genetischer Studien.
Im Folgenden werden einige der Krankheiten erwähnt, die mit Mutationen in Genen zusammenhängen, die DNA als Proteine vom Helikase-Typ codieren:
Werner-Syndrom
Es ist eine genetisch bedingte Krankheit, die durch eine Mutation in einem Gen namens WRN verursacht wird, das eine Helikase codiert. Die mutierte Helikase funktioniert nicht richtig und verursacht eine Reihe von Krankheiten, die zusammen das Werner-Syndrom ausmachen.
Das Hauptmerkmal derer, die an dieser Pathologie leiden, ist ihr vorzeitiges Altern. Damit sich die Krankheit manifestieren kann, muss das mutierte Gen von beiden Elternteilen geerbt werden. Die Inzidenz ist sehr gering und es gibt keine Behandlung für die Heilung.
Bloom-Syndrom
Das Bloom-Syndrom ist eine genetisch bedingte Krankheit, die aus der Mutation eines autosomalen Gens namens BLM resultiert, das für ein Helikase-Protein kodiert. Es tritt nur bei Personen auf, die homozygot für diesen Charakter sind (rezessiv)..
Das Hauptmerkmal dieser seltenen Krankheit ist die Überempfindlichkeit gegen Sonnenlicht, die Hautläsionen des erythromatösen Ausschlags verursacht. Es gibt noch keine Heilung.
Rothmund-Thomson-Syndrom
Es ist auch als angeborene atrophische Poikilodermie bekannt. Es handelt sich um eine Pathologie sehr seltenen genetischen Ursprungs: Bis heute sind weltweit weniger als 300 Fälle beschrieben.
Es wird durch eine Mutation im RECQ4-Gen verursacht, einem autosomalen und rezessiven Gen, das sich auf Chromosom 8 befindet.
Zu den Symptomen oder Zuständen dieses Syndroms gehören juvenile Katarakte, Anomalien im Skelettsystem, Depigmentierung, Kapillardilatationen und Atrophie der Haut (Poikilodermie). In einigen Fällen können Hyperthyreose und ein Mangel an Testosteronproduktion auftreten..
Verweise
- R.M. Brosh (2013). DNA-Helikasen, die an der DNA-Reparatur beteiligt sind, und ihre Rolle bei Krebs. Natur Bewertungen Krebs.
- Helicase. Von nature.com wiederhergestellt.
- Helicase. Von en.wikipedia.org wiederhergestellt.
- A. Juárez, L.P. Islas, A.M. Rivera, S.E. Tellez, M.A. Duran (2011). Rothmund-Thompson-Syndrom (angeborene atrophische Poikilodermie) bei einer schwangeren Frau. Klinik und Forschung in Gynäkologie und Geburtshilfe.
- K.D. Raney, A.K. Byrd, S. Aarattuthodiyil (2013). Struktur und Mechanismen von SF1-DNA-Helikasen. Fortschritte in der experimentellen Medizin und Biologie.
- Bloom-Syndrom. Von Medicina.ufm.edu wiederhergestellt.
- M. Singleton, M.S. Dillingham, D.B. Wigley (2007). Struktur und Mechanismus von Helikasen und Nukleinsäure-Translokasen. Jahresrückblick Biochemie.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.