
GLUT4 Eigenschaften, Struktur, Funktionen
GLUT4 Es ist ein Glukosetransporterprotein mit 509 Aminosäuren, das eine hohe Affinität zu diesem Zucker aufweist. Es gehört zur großen Haupt-Superfamilie der Facilitators (MSF), die durch 12 Transmembran-Alpha-Helices gekennzeichnet sind. Wie alle Mitglieder dieser Familie vermittelt es den erleichterten Transport von Glukose zugunsten seines Konzentrationsgradienten..
Seine Position ist auf Zellen beschränkt, die gegenüber Insulinstimulation empfindlich sind, wie Adipozyten und Myozyten. In diesem Sinne spielt GLUT4 eine Hauptrolle im primären Mechanismus der Glukoseabsorption unter Bedingungen einer Hyperglykämie im Blut..
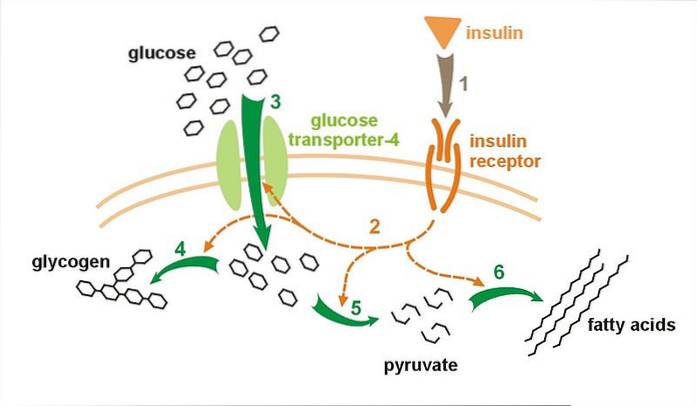
Ungefähr 95% des von der Zelle synthetisierten GLUT4 verbleiben im Cytosol in den Vesikeln. Diese Vesikel verschmelzen mit der Plasmamembran und legen den Rezeptor darin als Reaktion auf die Aktivierung der Insulin-vermittelten Exozytose frei..
Skelettmuskelübungen können angesichts des hohen Energiebedarfs dieser Zellen unter diesen Bedingungen auch die Verlagerung dieses Transporters in die Zellmembran fördern. Die Signale, die die Synthese bei längerer körperlicher Aktivität stimulieren, sind jedoch noch unbekannt..
Artikelverzeichnis
- 1 Funktionen
- 2 Struktur
- 2.1 Wie erfolgt der Glukosetransport durch GLUT4??
- 3 Funktionen
- 3.1 Mobilisierung von GLUT4-Vesikeln vom Cytosol zur Membran
- 4 Referenzen
Eigenschaften
Wie der konstitutive Expressionstransporter GLUT1 hat GLUT4 eine hohe Affinität zu Glucose, was sich in der Fähigkeit niederschlägt, Glucose zu binden, selbst wenn die Konzentration dieses Zuckers im Blut sehr niedrige Werte erreicht.
Im Gegensatz zu den Isoformen, die unter basalen Bedingungen für den Glukosetransport verantwortlich sind (GLUT1 und GLUT3), wird dieser Transporter nicht in der embryonalen Zellmembran exprimiert..
Im Gegenteil, es wird nur in Zellen adulter Gewebe exprimiert, hauptsächlich in peripheren Geweben, die reich an hohen Konzentrationen an braunem Fett sind, wie Herz, Skelettmuskel und Fettgewebe. Es wurde jedoch auch in den Zellen der Hypophyse und des Hypothalamus nachgewiesen.
In diesem Sinne ist es wichtig hervorzuheben, dass seine Verteilung, die auf Zellen beschränkt ist, die gegenüber Schwankungen der Insulinkonzentrationen empfindlich sind, mit der Tatsache zusammenhängt, dass es eine regulierte Expression durch dieses Hormon zeigt. Andere Untersuchungen haben gezeigt, dass die Muskelkontraktion auch einen regulatorischen Effekt auf die Expression dieses Transporters ausüben kann..
Andererseits haben subzelluläre Standortstudien gezeigt, dass GLUT2 einen doppelten Standort zwischen dem Cytosol und der Membran aufweist. In dem cytosolischen Kompartiment, in dem sich der höchste Prozentsatz befindet, befindet es sich in verschiedenen Kompartimenten: im Trans-Golgi-Netzwerk das frühe Endosom, Vesikel, die mit Clathrin und tubulo-vesikulären cytoplasmatischen Strukturen beschichtet sind oder nicht.
Struktur
Wie alle Mitglieder der Familie der Glukosetransporter, die am erleichterten passiven Transport dieser Hexose (GLUTs) beteiligt sind, ist GLUT4 ein α-Helix-Multipass-Transmembranprotein.
12 Transmembransegmente in α-Helix-Konfiguration kreuzen Plasmamembranen und subzelluläre Kompartimente (Vesikel) von Zellen, in denen GLUT 4 exprimiert wird.
Die Helices 3, 5, 7 und 11 sind räumlich verteilt, um die Bildung eines hydrophilen Kanals zu bewirken, durch den der Transit des Monosaccharids vom extrazellulären Raum zum Cytosol zugunsten eines Konzentrationsgradienten erfolgt..
Die Amino- und Carboxyltermini des Proteins sind in einer Konformationskonfiguration, die zur Bildung einer großen zentralen Schleife führt, auf das Zytoplasma ausgerichtet.
Der durch beide Enden begrenzte Bereich stellt eine funktionell wichtige Region des Proteins dar, da er sowohl an der Glukoseaufnahme und -bindung als auch an der Reaktion auf Insulinsignale beteiligt ist. Zusätzlich zu seiner Leitung von den zytosolischen vesikulären Kompartimenten zur Plasmamembran, wo es seine Funktion als Transporter ausüben wird.
Wie erfolgt der Glukosetransport durch GLUT4??
Wie alle Mitglieder der Familie der Glukosetransporter, die am erleichterten passiven Transport dieser Hexose (GLUTs) beteiligt sind, ist GLUT4 ein Multipass-Transmembranprotein in der α-Helix.
Eine durch die Bindung des Zuckers induzierte Verformung der Struktur mobilisiert die Bindungsstelle von der äußeren Düse der Membran zum Cytosol, wo sie freigesetzt wird. Sobald dies geschehen ist, erhält der Transporter wieder seine ursprüngliche Konformation, wodurch die Stelle Glucose auf der Außenseite der Membran ausgesetzt wird..
Eigenschaften
Das Glucosetransporterprotein vom Typ GLUT4 ist für die Mobilisierung von Glucose vom extrazellulären Medium zum Cytosol als Reaktion auf den Stimulus verantwortlich, der durch die verstärkte Sekretion von Insulin in Zellen von Geweben erzeugt wird, die für dieses Hormon empfindlich sind, wie z Skelettmuskel und Fettgewebe integrieren.
Um dies besser zu verstehen, ist es wichtig, sich daran zu erinnern, dass Insulin ein Hormon ist, das von den β-Zellen der Bauchspeicheldrüse als Reaktion auf hohe Konzentrationen von Glukose im Blut freigesetzt wird und physiologische Mechanismen in Gang setzt, die seine Absorption durch Zellen sowie die Synthese fördern von Glykogen..
Angesichts der Empfindlichkeit von GLUT4 gegenüber diesem Hormon fungiert es als Protagonist des primären Regulationsmechanismus der Glukoseabsorption. Eine Schlüsselrolle bei der schnellen Mobilisierung von Glukose aus dem Blut, wenn die Monosaccharidkonzentrationen sehr hohe Werte erreichen. Letzteres ist wichtig, um die Zellhomöostase aufrechtzuerhalten.
Diese schnelle Absorption von Glucose wird aufgrund der hohen Affinität dieses Transporters zu diesem Zucker ermöglicht. Mit anderen Worten, es ist in der Lage, es bereits in geringen Konzentrationen nachzuweisen, es schnell zu binden oder einzufangen..
Andererseits erklärt die Fähigkeit, Glukose in geringen Konzentrationen nachzuweisen, die Bedeutung der GLUT4-Expression in Skelettmuskelmembranen während des Trainings, eine Aktivität mit hohem Energiebedarf.
Mobilisierung von GLUT4-Vesikeln vom Cytosol zur Membran
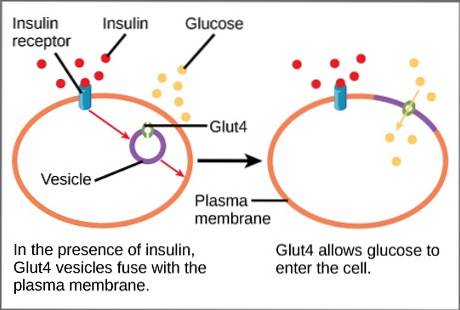
In Abwesenheit einer Insulinstimulation werden etwa 95% von GLUT4 in das Zytoplasma innerhalb von Vesikeln aus dem trans-Golgi-Netzwerk rekrutiert..
Wenn die Glukosekonzentrationen den physiologischen Wert weit überschreiten, wird eine Signalkaskade ausgelöst, die zur Freisetzung von Insulin aus der Bauchspeicheldrüse führt.
Das freigesetzte Insulin kann nun an den Insulinrezeptor binden, der auf der Membran von Myozyten und Adipozyten vorhanden ist, und die notwendigen Signale senden, um die Aktivierung der Exozytose auszulösen. Letzteres führt zur Fusion von GLUT4-tragenden Vesikeln mit der Plasmamembran..
Diese Fusion erhöht vorübergehend die Konzentration des Transporters in der Membran dieser Zellen. Das heißt, sobald der Blutzuckerspiegel auf den Ausgangswert abfällt, verschwindet der Reiz und der Transporter wird durch Aktivierung der Endozytose recycelt..
Verweise
- Bryant NJ, Govers R, James DE. Geregelter Transport des Glukosetransporters GLUT4. Nat Rev Mol Cell Biol. 2002; 3 (4): 267 & ndash; 277.
- Henriksen EJ. Eingeladene Überprüfung: Auswirkungen von akutem Training und Training auf die Insulinresistenz. J Appl Physiol (1985). 2002; 93 (2): 788 & ndash; 96.
- Huang S, tschechischer Abgeordneter. Der GLUT4-Glukosetransporter. Cell Metab. 2007; 5 (4): 237 & ndash; 252.
- Kraniou Y., Cameron-Smith D., Misso M., Collier G., Hargreaves M. Auswirkungen des Trainings auf die GLUT4- und Glycogenin-Genexpression im menschlichen Skelettmuskel. J Appl Physiol (1985). 2000; 88 (2): 794 & ndash; 6.
- Pessin JE, Thurmond DC, Elmendorf JS, Coker KJ, Okada S. Molekulare Basis des Insulin-stimulierten GLUT4-Vesikelhandels. Biol Chem. 1999; 274 (5): 2593 & ndash; 2596.
- Schulingkamp RJ, Pagano TC, Hung D, Raffa RB. Insulinrezeptoren und Insulinwirkung im Gehirn: Übersicht und klinische Implikationen. Neurowissenschaften und Bioverhaltensberichte. 2000; 855-872.
- Wood IS, Trayhurn P. Glukosetransporter (GLUT und SGLT): erweiterte Familien von Zuckertransportproteinen. Br J Nutr. 2003; 89 (1): 3-9. Zhao FQ, Keating AF. Funktionelle Eigenschaften und Genomik von Glukosetransportern. Curr Genomics. 2007; 8 (2): 113 & ndash; 28.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.