
Arten, Verfahren und Funktionen der Proteinglykosylierung

Das Proteinglykosylierung Es ist eine posttranslationale Modifikation, die aus der Addition linearer oder verzweigter Oligosaccharidketten an ein Protein besteht. Die resultierenden Glykoproteine sind im Allgemeinen Oberflächenproteine und Sekretionswegproteine..
Die Glykosylierung ist eine der häufigsten Peptidmodifikationen unter eukaryotischen Organismen, es wurde jedoch gezeigt, dass sie auch bei einigen Arten von Archaeen und Bakterien auftritt..
Bei Eukaryoten tritt dieser Mechanismus zwischen dem endoplasmatischen Retikulum (ER) und dem Golgi-Komplex auf, wobei verschiedene Enzyme sowohl an Regulationsprozessen als auch an der Bildung von kovalenten Protein + Oligosaccharid-Bindungen beteiligt sind..
Artikelverzeichnis
- 1 Arten der Glykolyse
- 1.1 N-Glykosylierung
- 1.2 O-Glykosylierung
- 1.3 C-Mannosylierung
- 1.4 Glypiation (aus dem Englischen "Glypiation")
- 2 Prozess
- 2.1 In Eukaryoten
- 2.2 In Prokaryoten
- 3 Funktionen
- 3.1 Bedeutung
- 4 Referenzen
Arten der Glykolyse
Abhängig von der Bindungsstelle des Oligosaccharids an das Protein kann die Glykosylierung in 4 Typen eingeteilt werden:
N.-Glykosylierung
Es ist das häufigste von allen und tritt auf, wenn Oligosaccharide an den Stickstoff der Amidgruppe der Asparaginreste im Asn-X-Ser / Thr-Motiv binden, wobei X eine beliebige Aminosäure außer Prolin sein kann.
ODER-Glykosylierung
Wenn Kohlenhydrate an die Hydroxylgruppe von Serin, Threonin, Hydroxylysin oder Tyrosin gebunden sind. Es ist eine weniger verbreitete Modifikation und Beispiele für Proteine wie Kollagen, Glycophorin und Mucine..
C.-Mannosilation
Es besteht aus der Zugabe eines Mannoserests, der über eine C-C-Bindung an das C2 der Indolgruppe in Tryptophanresten an das Protein bindet.
Glipiation (aus dem Englischen “Glypiation ")
Ein Polysaccharid fungiert als Brücke, um ein Protein an einen Glycosylphosphatidylinositol (GPI) -Anker auf der Membran zu binden.
Prozess
In Eukaryoten
Das N.-Die Glykosylierung wurde genauer untersucht. In Säugetierzellen beginnt der Prozess im rauen ER, wo ein vorgeformtes Polysaccharid an Proteine bindet, wenn diese aus Ribosomen austreten..
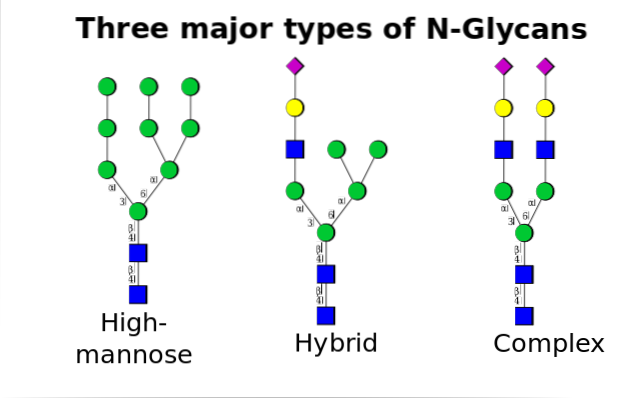
Das Vorläuferpolysaccharid besteht aus 14 Zuckerresten, nämlich: 3 Glucose (Glc) -, 9 Mannose (Man) - und 2 N-Acetylglucosamin (GlcNAc) -Resten.
Dieser Vorläufer kommt häufig bei Pflanzen, Tieren und einzelligen eukaryotischen Organismen vor. Es ist dank einer Bindung mit einem Dolicholmolekül, einem in die ER-Membran eingebetteten Isoprenoidlipid, an die Membran gebunden..
Nach seiner Synthese wird das Oligosaccharid durch den Oligosacryltransferase-Enzymkomplex auf einen Asparaginrest übertragen, der in der Tripeptidsequenz Asn-X-Ser / Thr eines Proteins enthalten ist, während es translatiert wird.
Die drei Glc-Reste am Ende des Oligosaccharids dienen als Signal für die korrekte Oligosaccharidsynthese und werden zusammen mit einem der Man-Reste gespalten, bevor das Protein zur weiteren Verarbeitung in den Golgi-Apparat transportiert wird..
Einmal im Golgi-Apparat können die an die Glykoproteine gebundenen Oligosaccharidanteile durch Zugabe von Galactose, Sialinsäure, Fucose und vielen anderen Resten modifiziert werden, was Ketten von viel größerer Vielfalt und Komplexität ergibt..
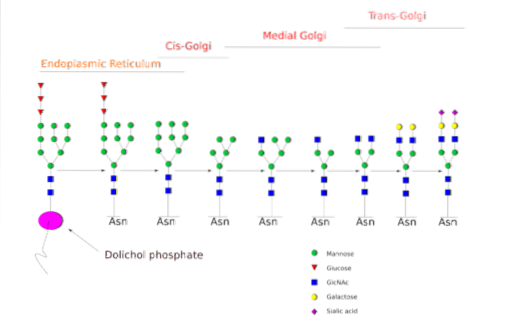
Die enzymatische Maschinerie, die zur Durchführung der Glykosylierungsprozesse benötigt wird, umfasst zahlreiche Glykosyltransferasen für die Zugabe von Zuckern, Glykosidasen für deren Entfernung und verschiedene Nukleotidzuckertransporter für den Beitrag der als Substrate verwendeten Reste..
In Prokaryoten
Bakterien haben keine intrazellulären Membransysteme, so dass die Bildung des anfänglichen Oligosaccharids (von nur 7 Resten) auf der cytosolischen Seite der Plasmamembran erfolgt..
Der Vorläufer wird auf einem Lipid synthetisiert, das dann durch eine ATP-abhängige Flipase in den periplasmatischen Raum transloziert wird, wo eine Glykosylierung auftritt..
Ein weiterer wichtiger Unterschied zwischen eukaryotischer und prokaryotischer Glykosylierung besteht darin, dass das Enzym Oligosaccharidtransferase (Oligosacaryltransferase) aus Bakterien Zuckerreste auf freie Teile bereits gefalteter Proteine übertragen kann, nicht da diese durch Ribosomen übersetzt werden..
Darüber hinaus ist das von diesem Enzym erkannte Peptidmotiv nicht dieselbe eukaryotische Tripeptidsequenz..
Eigenschaften
Das N.-An Glykoproteine gebundene Oligosaccharide dienen verschiedenen Zwecken. Beispielsweise erfordern einige Proteine diese posttranslationale Modifikation, um die richtige Faltung ihrer Struktur zu erreichen..
Für andere bietet es Stabilität, entweder durch Vermeidung eines proteolytischen Abbaus oder weil dieser Teil notwendig ist, damit sie ihre biologische Funktion erfüllen können..
Da Oligosaccharide einen starken hydrophilen Charakter haben, verändert ihre kovalente Addition an ein Protein notwendigerweise seine Polarität und Löslichkeit, was unter funktionellen Gesichtspunkten relevant sein kann..
Einmal an Membranproteine gebunden, sind Oligosaccharide wertvolle Informationsträger. Sie sind an den Prozessen der Signalisierung, Kommunikation, Erkennung, Migration und Zelladhäsion beteiligt.
Sie spielen eine wichtige Rolle bei der Blutgerinnung, Heilung und Immunantwort sowie bei der Verarbeitung der Proteinqualitätskontrolle, die glykanabhängig und für die Zelle unverzichtbar ist..
Bedeutung
Mindestens 18 genetisch bedingte Krankheiten wurden mit der Glykosylierung von Proteinen beim Menschen in Verbindung gebracht, von denen einige eine schlechte körperliche und geistige Entwicklung beinhalten, während andere tödlich sein können.
Es gibt eine wachsende Anzahl von Entdeckungen im Zusammenhang mit Glykosylierungskrankheiten, insbesondere bei pädiatrischen Patienten. Viele dieser Störungen sind angeboren und haben mit Defekten zu tun, die mit den Anfangsstadien der Oligosaccharidbildung oder mit der Regulation der an diesen Prozessen beteiligten Enzyme verbunden sind..
Da ein großer Teil der glykosylierten Proteine den Glykokalyx ausmacht, besteht ein wachsendes Interesse daran, zu überprüfen, ob Mutationen oder Veränderungen in den Glykosylierungsprozessen mit der Veränderung der Mikroumgebung von Tumorzellen zusammenhängen und somit das Fortschreiten von Tumoren und deren Entwicklung fördern können Metastasen bei Krebspatienten.
Verweise
- Aebi, M. (2013). N-verknüpfte Proteinglykosylierung im ER. Biochimica et Biophysica Acta, 1833(11), 2430 & ndash; 2437.
- Dennis, J. W., Granovsky, M. & Warren, C. E. (1999). Proteinglykosylierung in Entwicklung und Krankheit. BioEssays, einundzwanzig(5), 412-421.
- H. Lodish, A. Berk, C. A. Kaiser, M. Krieger, A. Bretscher, H. Ploegh,… Martin, K. (2003). Molekulare Zellbiologie (5. Aufl.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membranstrukturbiologie: mit biochemischen und biophysikalischen Grundlagen. Cambridge University Press. Abgerufen von www.cambrudge.org/9780521856553
- Nelson, D. L. & Cox, M. M. (2009). Lehninger Prinzipien der Biochemie. Omega-Ausgaben (5. Aufl.).
- H. Nothaft & C. M. Szymanski (2010). Proteinglykosylierung in Bakterien: Süßer als je zuvor. Nature Reviews Mikrobiologie, 8(11), 765 & ndash; 778.
- Ohtsubo, K. & Marth, J. D. (2006). Glykosylierung in zellulären Mechanismen von Gesundheit und Krankheit. Zelle, 126(5), 855 & ndash; 867.
- Spiro, R. G. (2002). Proteinglykosylierung: Art, Verteilung, enzymatische Bildung und Auswirkungen von Glycopeptidbindungen auf die Krankheit. Glykobiologie, 12(4), 43R-53R.
- S. R. Stowell, T. Ju & R. D. Cummings (2015). Proteinglykosylierung bei Krebs. Jahresrückblick Pathologie: Mechanismen von Krankheiten, 10(1), 473 & ndash; 510.
- Strasser, R. (2016). Glykosylierung von Pflanzenproteinen. Glykobiologie, 26(9), 926 & ndash; 939.
- Xu, C. & Ng, D.T.W. (2015). Glykosylierungsgerichtete Qualitätskontrolle der Proteinfaltung. Nature Reviews Molekulare Zellbiologie, 16(12), 742 & ndash; 752.
- Zhang, X. & Wang, Y. (2016). Qualitätskontrolle der Glykosylierung durch die Golgi-Struktur. Journal of Molecular Biology, 428(16), 3183 & ndash; 3193.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.