
Ideales Gasmodell, Verhalten, Beispiele
EIN ideales Gas oder perfektes Gas Es ist eines, bei dem die molekulare Anziehungs- oder Abstoßungskraft zwischen den Teilchen, aus denen es besteht, als unbedeutend angesehen wird, daher ist seine gesamte innere Energie kinetisch, dh Energie, die mit Bewegung verbunden ist.
In einem solchen Gas sind die Partikel normalerweise ziemlich weit voneinander entfernt, obwohl sie von Zeit zu Zeit miteinander und mit den Wänden des Behälters kollidieren..
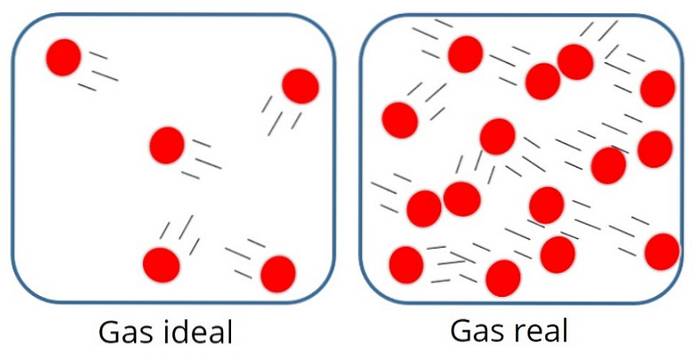
Andererseits spielt im idealen Gas weder die Größe noch die Masse der Partikel eine Rolle, da angenommen wird, dass das von ihnen eingenommene Volumen im Vergleich zum Volumen des Gases selbst sehr klein ist..
Dies ist natürlich nur eine Annäherung, da in der Realität immer ein gewisses Maß an Wechselwirkung zwischen Atomen und Molekülen besteht. Wir wissen auch, dass Teilchen Raum einnehmen und Masse haben..
Diese Annahmen funktionieren jedoch in vielen Fällen, wie z. B. Gasen mit niedrigem Molekulargewicht, in einem guten Bereich von Drücken und Temperaturen recht gut..
Gase mit hohem Molekulargewicht, insbesondere bei hohen Drücken oder niedrigen Temperaturen, verhalten sich jedoch überhaupt nicht wie ideale Gase, und es werden andere Modelle benötigt, die mit dem Ziel erstellt wurden, sie genauer zu beschreiben..
Artikelverzeichnis
- 1 Erste Versuche
- 1.1 Die idealen Gasgesetze
- 2 Ideales Gasmodell
- 2.1 Ideale Gaszustandsgleichung
- 2.2 Die Gaskonstante
- 3 Verhalten eines idealen Gases
- 4 Beispiele für ideale Gase
- 4.1 Edelgase
- 4.2 Der Heißluftballon
- 4.3 Heliumballons
- 5 Referenzen
Erste Experimente
Die Gesetze, die Gase regeln, sind empirisch, das heißt, sie sind aus Experimenten entstanden. Die bemerkenswertesten Experimente wurden im 17., 18. und frühen 19. Jahrhundert durchgeführt.
Erstens sind es die von Robert Boyle (1627-1691) und Edme Mariotte (1620-1684), die die Druck in einem Gas und zeichnete seine Änderung von Volumen, Feststellung, dass sie umgekehrt proportional waren: Je höher der Druck, desto kleiner das Volumen.

Jacques Charles (1746-1823) stellte seinerseits fest, dass der Band und Temperatur Absolutwerte waren direkt proportional, solange der Druck konstant blieb.
Amadeo Avogadro (1776-1856) entdeckte, dass zwei identische Volumina unterschiedlicher Gase die gleiche Anzahl von Partikeln enthielten, solange Druck und Temperatur gleich waren. Und schließlich erklärte Joseph de Gay Lussac (1778-1850), dass der Druck in einem Gas durch Festhalten des Volumens direkt proportional zur Temperatur ist..
Die idealen Gasgesetze
Diese Entdeckungen werden in einfachen Formeln ausgedrückt, die aufrufen p zu Druck, V. auf Lautstärke, n auf die Anzahl der Partikel und T. die ideale Gastemperatur:
Boyle-Mariotte-Gesetz
Solange die Temperatur festgelegt ist, tritt Folgendes auf:
p⋅V = konstant
Charles Law
Wenn das Gas unter konstantem Druck steht:
V / T = konstant
Gay Lussacs Gesetz
Wenn das Gas auf einem festen Volumen gehalten wird, ist davon ausgegangen, dass:
p / T = konstant
Avogadros Gesetz
Identische Gasvolumina haben unter den gleichen Druck- und Temperaturbedingungen die gleiche Anzahl von Partikeln. Deshalb können wir schreiben:
V ∝ n
Dabei ist n die Anzahl der Teilchen und ∝ das Symbol der Proportionalität.
Ideales Gasmodell
Das ideale Gasmodell beschreibt ein Gas so, dass:
-Wenn die Teilchen interagieren, tun sie dies für sehr kurze Zeit durch elastische Kollisionen, bei denen Impuls und kinetische Energie erhalten bleiben..
-Seine Partikelbestandteile sind pünktlich, mit anderen Worten, ihr Durchmesser ist viel kleiner als die durchschnittliche Entfernung, die sie zwischen einer Kollision und einer anderen zurücklegen..
-Intermolekulare Kräfte sind nicht vorhanden.
-Die kinetische Energie ist proportional zur Temperatur.
Monatomische Gase - deren Atome nicht miteinander verbunden sind - und ein niedriges Molekulargewicht weisen unter Standardbedingungen von Druck und Temperatur (Atmosphärendruck und 0ºC-Temperatur) ein derartiges Verhalten auf, dass das ideale Gasmodell eine sehr gute Beschreibung für sie ist.
Ideale Gaszustandsgleichung
Die oben aufgeführten Gasgesetze bilden zusammen die allgemeine Gleichung, die das Verhalten des idealen Gases regelt:
V ∝ n
V ∝ T.
Deshalb:
V ∝ n⋅T
Auch aus Boyles Gesetz:
V = Konstante / p
Also können wir das bestätigen:
V = (Konstante x n⋅T) / p
Die Konstante heißt die Gaskonstante und wird mit dem Buchstaben R bezeichnet. Mit dieser Wahl bezieht sich die ideale Gaszustandsgleichung auf vier Variablen, die den Zustand des Gases beschreiben, nämlich n, R, p und T, wobei übrig bleibt:
p⋅V = n⋅R⋅T
Diese relativ einfache Gleichung stimmt mit den idealen Gasgesetzen überein. Wenn beispielsweise die Temperatur konstant ist, reduziert sich die Gleichung auf das Boyle-Mariotte-Gesetz.
Die Gaskonstante
Wie bereits erwähnt, liegt das Verhalten vieler Gase unter Standardbedingungen von Temperatur und Druck, dh bei 0 ° C (273,15 K) und 1 Atmosphäre Druck, nahe am Verhalten des idealen Gases. Unter diesen Bedingungen beträgt das Volumen von 1 Mol des Gases 22.414 l.
In diesem Fall:
R = (p · V) / (n · T) = (1 atm · 22,414 l) / (1 mol · 273,15 K) = 0,0821 atm · l / mol · K.
Die Gaskonstante kann auch in anderen Einheiten ausgedrückt werden, zum Beispiel im SI International System, das es wert ist:
R = 8,314 J · mol-1⋅ K.-1
Bei der Lösung eines Problems unter Verwendung des idealen Gasgesetzes ist es zweckmäßig, auf die Einheiten zu achten, in denen die Konstante ausgedrückt wird, da es, wie wir sehen können, viele Möglichkeiten gibt.
Verhalten eines idealen Gases
Wie bereits erwähnt, verhält sich jedes Gas unter normalen Druck- und Temperaturbedingungen mit niedrigem Molekulargewicht sehr nahe am idealen Gas. Daher ist die Gleichung p⋅V = n⋅R⋅T anwendbar, um die Beziehung zwischen den vier Variablen zu finden, die sie beschreiben: n, p, V und T..
Auf diese Weise können wir uns einen Teil des idealen Gases vorstellen, der in einem Behälter eingeschlossen ist und von winzigen Partikeln gebildet wird, die von Zeit zu Zeit miteinander und mit den Wänden des Behälters immer elastisch kollidieren..
Dies sehen wir in der folgenden Animation eines Teils von Helium, einem einatomigen Edelgas:
Beispiele für ideale Gase
Ein ideales Gas ist ein hypothetisches Gas, das heißt, es ist eine Idealisierung. In der Praxis verhalten sich jedoch viele Gase sehr eng, so dass das Modell p⋅V = n⋅R arroT sehr gute Ergebnisse liefern kann.
Edelgase
Beispiele für Gase, die sich unter Standardbedingungen als ideal verhalten, sind Edelgase sowie leichte Gase: Wasserstoff, Sauerstoff und Stickstoff..
Der aerostatische Ballon

Das Charles'sche Gesetz kann auf den Heißluftballon in Abbildung 1 angewendet werden: Das Gas erwärmt sich, daher dehnt sich die Luft, die den Ballon füllt, aus und steigt infolgedessen auf.
Heliumballons
Helium ist neben Wasserstoff das häufigste Element im Universum und dennoch auf der Erde selten. Da es sich um ein Edelgas handelt, ist es im Gegensatz zu Wasserstoff inert, weshalb heliumgefüllte Ballons häufig als dekorative Elemente verwendet werden..
Verweise
- Atkins, P. 1999. Physikalische Chemie. Omega-Ausgaben.
- Chang, R. 2013. Chemie. 11 .. Auflage. Mc Graw Hill Ausbildung.
- Cengel, Y. 2012. Thermodynamik. 7. Auflage. Mcgraw Hügel.
- Cimbala, C. 2006. Strömungsmechanik, Grundlagen und Anwendungen. Mc. Graw Hill.
- Giambattista, A. 2010. Physik. 2 .. Ed. McGraw Hill.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.