
Struktur, Eigenschaften, Verwendungen der Kaliumphosphat (K3PO4)
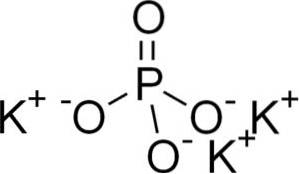
Das Kaliumphosphat ist eine anorganische Verbindung, die aus drei Kalium-K-Ionen besteht+ und ein Phosphation PO43-. Seine chemische Formel lautet K.3PO4. Es ist ein farbloser oder weißer kristalliner Feststoff. Es ist in Wasser sehr gut löslich und bildet alkalische Lösungen, dh mit vielen OH-Ionen-, daher basischer pH.
Das Phosphation hat in Zellen eine wichtige Funktion, die mit Energiespeicherung zu tun hat. Kaliumphosphat wird häufig in Reaktionen der organischen Chemie verwendet, wo es als Base fungieren kann, dh H-Protonen aufnehmen kann+. Es kann auch als Katalysator oder Beschleuniger einiger Reaktionen fungieren.

Es wurde verwendet, um den Befall bestimmter Insekten auf Weizenpflanzen zu verringern, da es diese resistenter gegen diese macht. Es wurde jedoch beobachtet, dass es die Entwicklung von Methan (CH) begünstigt4), ein Treibhausgas aus Reismikrokulturen.
Es wurde unter anderem als Abführmittel verwendet, um die Dauer der Lokalanästhesie zu verlängern, Hohlräume zu stoppen und Oberflächen zu beschichten.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3,6 pH
- 3.7 Chemische Eigenschaften
- 3.8 Andere Eigenschaften
- 3.9 Rolle von Phosphat im menschlichen Körper
- 4 Erhalten
- 5 Verwendungen
- 5.1 Als Grundlage für Reaktionen in der organischen Chemie
- 5.2 Als Katalysator
- 5.3 In der Landwirtschaft
- 5.4 In medizinischen Anwendungen
- 5.5 Als Abführmittel
- 5.6 In der Veterinärmedizin
- 5.7 Bei der Gewinnung von DNA
- 5.8 In verschiedenen Anwendungen
- 5.9 Negativer Aspekt für die Verwendung in der Landwirtschaft
- 6 Referenzen
Struktur
Kaliumphosphat besteht aus drei Kalium-K-Kationen+ und ein Phosphatanion PO43-.
Das Phosphation PO43- Es besteht aus einem Phosphoratom (P) und vier Sauerstoffatomen (O), wobei Phosphor eine Oxidationsstufe von +5 und Sauerstoff eine Wertigkeit von -2 aufweist.
Nomenklatur
- Kaliumphosphat
- Trikaliumphosphat
- Tribasisches Kaliumphosphat
- Tripotiumorthophosphat
Eigenschaften
Körperlicher Status
Farbloser oder weißer kristalliner Feststoff.
Molekulargewicht
212,27 g / mol
Schmelzpunkt
1340 ºC
Dichte
2,564 g / cm3
Löslichkeit
In Wasser sehr gut löslich: 106 g / 100 g Wasser bei 25 ° C. Unlöslich in Ethanol.
pH
Eine Lösung mit 1% K.3PO4 hat einen pH von 11,5-12,3.
Chemische Eigenschaften
In Wasser gelöst trennt sich Kaliumphosphat in die drei Kalium-K-Kationen.+ und das Phosphatanion PO43-. Das Phosphatanion nimmt ein Proton aus dem Wasser und das Hydrogenphosphatanion HPO wird gebildet4zwei-. Letzteres nimmt wiederum ein weiteres Proton aus dem Wasser und wird zum Dihydrogenphosphatanion H.zweiPO4-.
PO43- + H.zweiO ⇔ HPO4zwei- + Oh-
HPO4zwei- + H.zweiO ⇔ H.zweiPO4- + Oh-
B. OH-Ionen gebildet werden- wässrige Lösung wird alkalisch.
Andere Eigenschaften
Zusätzlich zur wasserfreien Form (ohne Wasser) hat es mehrere hydratisierte Formen; Dies bedeutet, dass das K-Molekül3PO4 kann von einem oder mehreren Wassermolekülen innerhalb der Kristallstruktur begleitet sein.
Aus diesem Grund kann es beispielsweise das Monohydrat K bilden3PO4.H.zweiOder das Trihydrat K.3PO4.3HzweiOder das Heptahydrat und das Nonahydrat.
Rolle von Phosphat im menschlichen Körper
Das Phosphation PO43- Es ist das am häufigsten vorkommende Anion in Zellen und spielt eine wichtige Rolle bei der Energiespeicherung.
Das Phosphation ist auch an der Bildung und Ernährung von Knochen und Zähnen beteiligt, da es die Calciumkonzentration im Blutserum und an zahlreichen Energieübertragungsreaktionen in der Zelle reguliert..
Erhalten
Kaliumphosphat kann ausgehend von der Reaktion zwischen Kaliumchlorid KCl und Ammoniumphosphat (NH) erhalten werden4)3PO4.
Kaliumchlorid + Ammoniumphosphat → Kaliumphosphat + Ammoniumchlorid
3 KCl + (NH4)3PO4 → K.3PO4 + 3 NH4Cl
Anwendungen
Als Grundlage für Reaktionen in der organischen Chemie
Kalium-K-Phosphat3PO4 Es wurde in verschiedenen Reaktionen der organischen Chemie verwendet. Beispielsweise dient es zur Synthese von Acetylenen ausgehend von dibromierten Verbindungen..
Bei dieser Synthese tritt eine Dehydrobromierung (Eliminierung von Wasserstoff und Brom) auf, wobei K.3PO4 wasserfreier Feststoff (ohne Wasser) wirkt als weiche Base und entnimmt dem Molekül zwei Protonen, die beiden Bromatome werden entfernt und das entsprechende Acetylen erhalten.
C.6H.5-CHBr-CHzweiBr + 2 K.3PO4 → C.6H.5-C≡CH + 2 KBr + 2 K.zweiHPO4

Als Katalysator
Das K3PO4 dient als Katalysator bei verschiedenen Reaktionen der organischen Chemie. Beispielsweise wurde es als Feststoff verwendet, um Biodiesel aus gebrauchtem Frittieröl zu erhalten..
Biodiesel ist ein Diesel ähnlicher Kraftstoff, der jedoch aus verwendeten oder nicht verwendeten Fetten oder natürlichen Ölen gewonnen wird.
Kaliumphosphat war als Katalysator oder Beschleuniger dieser Reaktion wirksamer als Natriumphosphat Na3PO4 und Calciumoxid CaO.
In der Landwirtschaft
Das K3PO4 wurde verwendet, um Weizenpflanzen zu behandeln und sie gegen bestimmte Schädlinge resistent zu machen.

Einige Forscher behandelten Weizensämlinge mit Kaliumphosphat und es stellte sich heraus, dass es eine Resistenz gegen Blattläuse induziert. Diuraphis noxia, ein Insekt, das diese Pflanzen angreift.
Nach dem Auftragen einer verdünnten Lösung von K.3PO4 Bei den Sämlingen wurde eine geringere Schwere der durch diese Insekten verursachten Symptome und eine Abnahme der Anzahl der Blattläuse beobachtet, die sich von ihnen ernährten.

In medizinischen Anwendungen
Kaliumphosphat wurde verwendet, um die anästhetische Wirkung von Lidocain, einem Lokalanästhetikum, zu modifizieren. Ein Lokalanästhetikum ist ein Medikament, das bei Anwendung auf einen Bereich des Körpers zu einem Verlust der Schmerzempfindlichkeit in diesem Bereich führt..
Es wurde festgestellt, dass der K.3PO4 ermöglicht die Verlängerung der Lokalanästhesie von Lidocain.
Als Abführmittel
Kaliumphosphat erhöht die Fließfähigkeit des Darminhalts, da es hilft, Wasser im Darm zu halten, was indirekt die Kontraktion des Darmmuskels induziert.
In der Veterinärmedizin
Das K3PO4 wird bei Tieren mit diabetischer Ketoazidose (eine Komplikation von Diabetes) zur Behandlung von Hypophosphatämie (geringe Menge an Phosphat im Blut) angewendet..
Bei übermäßiger Gabe kann es jedoch zu Hypokalzämie (wenig Kalzium im Blut), Hyperphosphatämie (überschüssiges Phosphat im Blut), unwillkürlicher Kontraktion der Muskeln, Mineralisierung der Weichteile und Nierenversagen kommen..
Bei der Gewinnung von DNA
Kaliumphosphat wurde als Puffer zur Reinigung von DNA in Genetiklabors verwendet.
DNA ist ein Protein, das in Zellen vorkommt und alle genetischen Informationen enthält, die für die Entwicklung und Funktion von Lebewesen erforderlich sind..
Durch die Isolierung von DNA untersuchen Wissenschaftler, wie erbliche Merkmale übertragen werden, weshalb Kaliumphosphat sehr hilfreich ist.
In verschiedenen Anwendungen
Kalium-K-Phosphat3PO4 es dient:
- als Nahrungsergänzungsmittel,
- zum Elektrolytersatz,
- als Puffer, dh als chemisches System, das die Kontrolle der OH-Ionenwerte ermöglicht- oder Wasserstoff H.+ in wässriger Lösung,
- Karies zu verlangsamen oder zu hemmen,
- als Korrosionsinhibitor und Antifoulingmittel,
- als Oberflächenbehandlungsmittel und Beschichtungsmittel,
- als Frostschutzmittel,
- in Reinigungsmitteln.

Negativer Aspekt für den Einsatz in der Landwirtschaft
Bestimmte Forscher fanden heraus, dass das Hinzufügen von K.3PO4 Eine Mikrokultur von Reis erhöht die Methanemission (CH)4) in die Atmosphäre. Methan ist ein Gas, das zum Treibhauseffekt beiträgt und die Temperatur unseres Planeten erhöht.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Kaliumphosphat. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Panciera, D.L. (2012). Flüssigkeitstherapie bei endokrinen und Stoffwechselstörungen. Phosphorergänzung. Bei Flüssigkeits-, Elektrolyt- und Säure-Base-Störungen in der Kleintierpraxis (4. Auflage). Von sciencedirect.com wiederhergestellt.
- Shenawi-Khalil, S. et al. (2012). Synthese von Acetylenen durch Dehydrobromierung unter Verwendung von festem wasserfreiem Kaliumphosphat als Base unter Phasentransferbedingungen. Tetrahedron Letters, Band 53, Ausgabe 18, 2012, Seiten 2295-2297. Von sciencedirect.com wiederhergestellt.
- Guan, G. et al. (2009). Trikaliumphosphat als fester Katalysator für die Biodieselherstellung aus Speiseölabfällen. Fuel Processing Technology, Band 90, Ausgabe 4, 2009, Seiten 520-524. Von sciencedirect.com wiederhergestellt.
- Kulkami, M.A. (2012). Mechanistischer Ansatz zur schnellen und lösungsmittelfreien Synthese von α-Hydroxyposphonaten unter Verwendung von Kaliumphosphat als Katalysator. Comptes Rendus Chimie, Band 16, Ausgabe 2, 2013, Seiten 148-152. Von sciencedirect.com wiederhergestellt.
- Venter, E. et al. (2014). Kaliumphosphat induziert Toleranz gegenüber der russischen Weizenblattlaus (Diuraphis noxia, Homoptera: Aphididae) in Weizen. Crop Protection Vol 61, Juli 2014, Seiten 43-50. Von sciencedirect.com wiederhergestellt.
- N. Bonturi et al. (2013). Natriumcitrat und Kaliumphosphat als alternative Adsorptionspuffer bei der hydrophoben und aromatischen thiophilen chromatographischen Reinigung von Plasmid-DNA aus neutralisiertem Lysat. Journal of Chromatography B, Bände 919-920, 2013, Seiten 67-74. Von sciencedirect.com wiederhergestellt.
- Conrad, R. und Klose, M. (2005). Einfluss der Kaliumphosphatdüngung auf die Produktion und Emission von Methan und seinen 13C-stabile Isotopenzusammensetzung im Reismikrokosmos. Bodenbiologie und Biochemie, Band 37, Ausgabe 11, 2005, Seiten 2099-2108. Von sciencedirect.com wiederhergestellt.
- Lide, D.R. (Herausgeber) (2003). CRC Handbuch für Chemie und Physik. 85th CRC Drücken Sie.
- Rauchfuß. (2019). Trikaliumphosphat. Von en.wikipedia.org wiederhergestellt



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.