
Calciumfluorid (CaF2) -Struktur, Eigenschaften, Verwendungen
Das Calciumfluorid Es ist ein anorganischer Feststoff, der aus einem Calciumatom (Ca) und zwei Fluoratomen (F) besteht. Seine chemische Formel lautet CaFzwei und es ist ein kristalliner grauweißer Feststoff.
In der Natur kommt es im Mineral Fluorit oder Flussspat vor. Es kommt natürlich in Knochen und Zähnen vor. Das Mineral Fluorit ist die Hauptquelle für die Gewinnung anderer Fluorverbindungen.

Darüber hinaus ist das CaFzwei Es wird zur Vorbeugung von Zahnhöhlen verwendet und daher Materialien zugesetzt, die von Zahnärzten zur Heilung verwendet werden. Tatsächlich wird dem Trinkwasser (trinkbares Wasser) auch Calciumfluorid zugesetzt, damit die Bevölkerung davon profitiert, es einzunehmen und sich die Zähne zu putzen..
Das CaFzwei Es wird in Form großer Kristalle in optischen Geräten und Kameras verwendet. Es wird auch in kleinen Geräten verwendet, mit denen festgestellt wird, wie stark eine Person Radioaktivität ausgesetzt war.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Brechungsindex
- 3.7 Löslichkeit
- 3.8 Chemische Eigenschaften
- 4 Präsenz in der Natur
- 5 Verwendungen
- 5.1 - Bei der Gewinnung von Fluorverbindungen
- 5.2 - Bei der Pflege von Zähnen
- 5.3 - In Objektiven für optische Geräte
- 5.4 - In der metallurgischen Industrie
- 5.5 - In Detektoren für Radioaktivität oder gefährliche Strahlung
- 5.6 - Andere Verwendungen
- 6 Referenzen
Struktur
CaF Calciumfluoridzwei ist eine ionische Verbindung, die durch ein Calciumkation Ca gebildet wirdzwei+ und zwei Fluoridanionen F.-. Einige Informationsquellen weisen jedoch darauf hin, dass ihre Links einen bestimmten kovalenten Charakter haben.
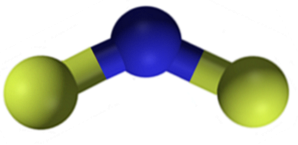
Nomenklatur
Calciumfluorid
Eigenschaften
Körperlicher Status
Farbloser bis grauweißer Feststoff mit kubischer Kristallstruktur.
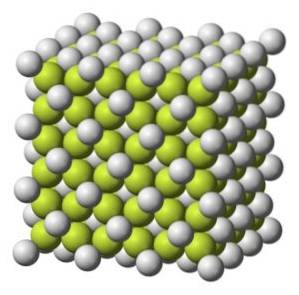
Molekulargewicht
78,07 g / mol
Schmelzpunkt
1418 ºC
Siedepunkt
2533 ºC
Dichte
3,18 g / cm3 bei 20 ° C..
Brechungsindex
1,4328
Löslichkeit
Bei 20 ° C ist es wasserunlöslich. Bei 25 ° C fast unlöslich: 0,002 g / 100 ml Wasser. In Säuren schwer löslich.
Chemische Eigenschaften
Seine oxidierenden oder reduzierenden Eigenschaften sind sehr schwach, diese Reaktionen können jedoch auftreten. Obwohl im Allgemeinen in sehr wenigen Fällen.
Es ist inert gegenüber organischen Chemikalien und vielen Säuren, einschließlich HF-Flusssäure. Löst sich langsam in Salpetersäure HNO auf3.
Es ist nicht brennbar. Reagiert nicht schnell mit Luft oder Wasser.
Aufgrund seiner geringen Affinität zu Wasser wirkt es sich auch bei normaler Raumtemperatur nicht bis zu einem Monat aus, selbst wenn es einem hohen Prozentsatz an Feuchtigkeit ausgesetzt ist..
In Gegenwart von Feuchtigkeit lösen sich die Wände seiner Kristalle bei Temperaturen über 600 ° C langsam auf. In trockenen Umgebungen kann es bis zu etwa 1000 ° C verwendet werden, ohne dass dies merklich beeinträchtigt wird.
Präsenz in der Natur
CaF Calciumfluoridzwei natürlich im Mineral Fluorit oder Flussspat gefunden.
Obwohl das CaFzwei rein ist farblos das Mineral Fluorit, es wird oft durch die Anwesenheit von Elektronen gefärbt, die in den "Löchern" der kristallinen Struktur eingeschlossen sind.
Dieses Mineral ist hoch geschätzt für seinen glasigen Glanz und die Vielfalt der Farben (lila, blau, grün, gelb, farblos, braun, rosa, schwarz und rötlich-orange). Es soll "das farbigste Mineral der Welt" sein..





Calciumfluorid kommt auch in Mengen zwischen 0,2 und 0,65% in den Knochen und in 0,33 bis 0,59% im Zahnschmelz vor..
Anwendungen
- Bei der Gewinnung von Fluorverbindungen
Das Mineral Fluorit CaFzwei Es ist die Grund- oder Mehrheitsquelle für Fluor weltweit. Es ist der Rohstoff für die Herstellung fast aller Fluorverbindungen.
Das wichtigste davon ist Flusssäure HF, aus der die anderen fluorierten Verbindungen hergestellt werden. Das Fluoridion F.- durch Reaktion mit konzentrierter Schwefelsäure H aus dem Mineral freigesetztzweiSW4::
CaFzwei (fest) + H.zweiSW4 (flüssig) → CaSO4 (fest) + 2 HF (Gas)
- Bei der Pflege von Zähnen
CaF Calciumfluoridzwei Es ist ein Mittel zur Vorbeugung von Hohlräumen. Zu diesem Zweck wird Trinkwasser (trinkbares Wasser) fluoridiert.
Weiterhin sind die geringen Konzentrationen an Fluorid F.- Es wurde gezeigt, dass die Verwendung von Zahnpasten und Mundwässern (in der Größenordnung von 0,1 ppm) einen tiefgreifenden positiven Effekt auf die vorbeugende Zahnpflege von Hohlräumen hat.

CaF-Nanopartikelzwei effektiver
Obwohl Fluoride in Zahnpasten und Spülungen verwendet werden, führt die geringe Konzentration von Calcium (Ca) im Speichel dazu, dass sich keine CaF-Ablagerungen bilden.zwei auf die Zähne so effektiv wie möglich.
Aus diesem Grund wurde ein Weg gefunden, um CaF-Pulver zu erhalten.zwei als Nanopartikel.
Hierzu wird ein Sprühtrockner verwendet (aus dem Englischen Sprühtrockner) wobei zwei Lösungen (eine von Calciumhydroxid Ca (OH)zwei und eines von Ammoniumfluorid NH4F) werden gemischt, während sie in einer Kammer mit heißem Luftstrom gesprüht werden.
Dann tritt die folgende Reaktion auf:
Ca (OH)zwei + NH4F → CaFzwei (fest) + NH4Oh
NH4OH verflüchtigt sich als NH3 und H.zweiOder und die CaF-Nanopartikel bleiben erhaltenzwei.
Diese weisen eine hohe Reaktivität und eine höhere Löslichkeit auf, wodurch sie für die Remineralisierung von Zähnen und als Antikaries wirksamer sind.
- In Objektiven für optische Geräte
Calciumfluorid wird verwendet, um optische Elemente wie Prismen und Fenster von Infrarot- und Ultraviolett (UV) -Lichtspektrophotometern aufzubauen..
Mit diesen Geräten können wir die Lichtmenge messen, die von einem Material absorbiert wird, wenn es durch es hindurchgeht.
Das CaFzwei Es ist in diesen Bereichen des Lichtspektrums transparent, hat einen extrem niedrigen Brechungsindex und ermöglicht eine effizientere Auflösung als NaCl im Bereich von 1500 bis 4000 cm.-1.
Dank seiner chemischen Stabilität hält es widrigen Bedingungen stand, weshalb optische CaF-Elementezwei Sie werden nicht angegriffen. Es hat auch eine hohe Härte.
In Kameras
Einige Kamerahersteller verwenden CaF-Objektivezwei künstlich kristallisiert, um die Lichtstreuung zu reduzieren und eine hervorragende Farbverzerrungskorrektur zu erzielen.

- In der metallurgischen Industrie
Das CaFzwei Es wird als Flussmittel in der metallurgischen Industrie verwendet, da es eine in Wasser unlösliche Calciumquelle ist und daher bei sauerstoffempfindlichen Anwendungen wirksam ist..
Es wird verwendet, um Eisen und Stahl in flüssiger Form zu schmelzen und zu verarbeiten. Dies beruht auf der Tatsache, dass es einen ähnlichen Schmelzpunkt wie Eisen hat und auch Oxide und Metalle lösen kann..
- In Detektoren für Radioaktivität oder gefährliche Strahlung
Das CaFzwei Es ist ein thermolumineszierendes Material. Dies bedeutet, dass es Strahlung in den Elektronen seiner Kristallstruktur absorbieren und später beim Erhitzen in Form von Licht freisetzen kann..
Dieses emittierte Licht kann durch ein elektrisches Signal gemessen werden. Dieses Signal ist proportional zur Strahlungsmenge, die das Material empfangen hat. Dies bedeutet, dass je größer die empfangene Strahlungsmenge ist, desto mehr Licht wird nach dem Erhitzen emittiert..
Aus diesem Grund ist der CaFzwei Es wird in sogenannten Personendosimetern verwendet, die von Personen verwendet werden, die gefährlicher Strahlung ausgesetzt sind und wissen möchten, wie viel Strahlung sie in einem bestimmten Zeitraum erhalten haben.
- Andere Verwendungen
- Es wird als Katalysator bei chemischen Dehydratisierungs- und Dehydrierungsreaktionen zur Synthese organischer Verbindungen verwendet.
- Es wird in alkalischen Schweißelektroden verwendet. Es wird eine stärkere Schweißnaht erzielt als bei sauren Elektroden. Diese Elektroden sind nützlich bei der Herstellung von Schiffen und Hochdruckstahlbehältern..
- Als Nahrungsergänzungsmittel in extrem geringen Mengen (ppm oder parts per million).

Verweise
- Pirmoradian, M. und Hooshmand, T. (2019). Remineralisierung und antibakterielle Eigenschaften von zahnärztlichen Nanokompositen auf Harzbasis. Synthese und Charakterisierung von Calciumfluorid (CaFzwei). In Anwendungen von Nanokompositmaterialien in der Zahnmedizin. Von sciencedirect.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Calciumfluorid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Weman, K. (2012). Manuelles Metalllichtbogenschweißen (MMA) mit beschichteten Elektroden. Im Handbuch für Schweißprozesse (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Hanning, M. und Hanning, C. (2013). Nanobiomaterialien in der präventiven Zahnheilkunde. Calciumfluorid in Nanogröße. In Nanobiomaterialien in der klinischen Zahnheilkunde. Von sciencedirect.com wiederhergestellt.
- Ropp, R.C. (2013). Erdalkaliverbindungen der Gruppe 17 (H, F, Cl, Br, I). Calciumfluorid. In der Enzyklopädie der Erdalkaliverbindungen. Von sciencedirect.com wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Valkovic, V. (2000). Messungen der Radioaktivität. In der Radioaktivität in der Umwelt. Thermolumineszenzdetektoren (TLDs). Von sciencedirect.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.