
Chlordioxid (ClO2) -Struktur, Verwendung, Gewinnung, Risiken, Eigenschaften

Das Chlordioxid Es ist eine anorganische Verbindung, die aus dem Element Chlor (Cl) und Sauerstoff (O) besteht. Seine chemische Formel lautet ClOzwei. Es ist ein grünlich-gelbes bis rötliches Gas. Es kommt natürlicherweise nicht in der Umwelt vor.
Es ist äußerst reaktiv, daher ist es üblich, dass es dort hergestellt wird, wo es verwendet werden soll. Eine seiner wichtigsten Anwendungen ist die Verwendung als Mikrobizid, Antiseptikum und Desodorierungsmittel, da es Bakterien, Viren und Pilze sehr leicht und in sehr geringen Konzentrationen beseitigt..

Ermöglicht die Desinfektion von Lebensmitteln wie Gemüse, Obst, Fleisch, Geflügel und Meeresfrüchten. Es wird zur Desinfektion von Oberflächen, Böden, Badezimmern, Lüftungssystemen, Schwimmbädern, Laborgeräten, zahnärztlichen Geräten usw. verwendet..
Aus diesem Grund wird es in der Lebensmittelverarbeitung, in Krankenhäusern und Kliniken, in Industrien und Geschäften eingesetzt. Es wird zur Reinigung von Trinkwasser und kommunalem Abwasser verwendet.
Es ist sehr effektiv als Oxidationsmittel, weshalb es unter anderem zum Bleichen von Papierzellstoff, Ölen, Mehl, Leder und Textilfasern verwendet wird..
Wenn es in Form eines Gases vorliegt, ist es sehr gefährlich, da es hochexplosiv ist und hauptsächlich in wässrigen Lösungen verwendet wird. Es ist giftig, wenn es eingeatmet wird.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3.7 Chemische Eigenschaften
- 3.8 Eigenschaften seiner wässrigen Lösungen
- 3.9 Andere Eigenschaften
- 4 Erhalten
- 5 Wird als Desinfektionsmittel verwendet
- 5.1 In Lebensmitteln
- 5.2 Auf Papier und Pappe, die mit Lebensmitteln in Kontakt kommen
- 5.3 Im Trinkwasser
- 5.4 In der Zahnmedizin
- 5.5 In medizinischen Anwendungen
- 6 Andere Verwendungen
- 7 Risiken
- 8 Referenzen
Struktur
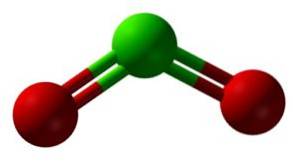
Chlordioxid entsteht durch die Vereinigung eines Chloratoms (Cl) mit zwei Sauerstoffatomen (O). Die Bindungen von Chlor mit jedem Sauerstoff sind kovalent und doppelt. Chlor in dieser Verbindung hat eine Wertigkeit von +4.
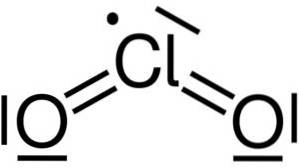
Es hat eine symmetrische und abgewinkelte Struktur, da es freie Elektronen hat. Das heißt, sie bilden keine Bindung mit einem anderen Atom.
Nomenklatur
- Chlordioxid
- Chloroxid (iv)
Eigenschaften
Körperlicher Status
Grünlich-gelbes bis rotgelbes Gas.
Molekulargewicht
67,45 g / mol.
Schmelzpunkt
-59 ºC.
Siedepunkt
11 ºC.
Dichte
Flüssigkeit bei 0 ° C = 1.642 g / cm3
Gas = 2,33 (relative Dichte zu Luft, Luft = 1).
Löslichkeit
In Wasser löslich: 2000 cm3 des ClOzwei Gas in 100 cm3 kaltes Wasser oder 0,8 g / 100 ml Wasser bei 20 ° C. Löslich in alkalischer Lösung und in Schwefelsäurelösung H.zweiSW4.
Chemische Eigenschaften
Der ClOzwei es ist extrem reaktiv und kann heftig explodieren. Es ist ein sehr wirksames Oxidationsmittel.
Der ClOzwei es zersetzt sich heftig, wenn es mit organischen Materialien in Kontakt kommt. Befindet es sich in Luft mit einer Konzentration von mehr als 10%, kann es aufgrund von Sonnenlicht oder Hitze explodieren.
Es kann auch in Gegenwart von Quecksilber (Hg) oder Kohlenmonoxid (CO) detonieren..
Unter Einwirkung von ultraviolettem (UV) Licht oder Ozon wird ClOzwei wird Chlorhexoxid ClzweiODER6, sehr instabile Verbindung.
Eigenschaften Ihrer wässrigen Lösungen
Seine wässrigen Lösungen sind gelb oder rotgelb. Sie sind stabil, wenn sie kühl, gut versiegelt und vor Sonnenlicht geschützt sind. In Gegenwart von Licht zersetzen sich diese Lösungen langsam zu Salzsäure HCl und Chlorsäure HClO.3.

In alkalischen Lösungen wird ClOzwei zersetzt sich in Chloritionen ClOzwei- und Chlorat ClO3-. Chlorsäure HClO wird in sauren Lösungen gebildetzwei und dann zersetzt sich dies zu Salzsäure HCl und Chlorsäure HClO3.
Andere Eigenschaften
Die konzentrierten Dämpfe von ClOzwei Sie sind potenziell explosiv, so dass es nicht möglich war, sie allein oder gemischt mit anderen Gasen zu komprimieren. Aus diesem Grund wird es bevorzugt, es an der Stelle vorzubereiten, an der es verwendet werden soll..
Wenn es in seiner hydratisierten Form, wie es manchmal übertragen wird, sehr niedrige Temperaturen aufweist, ist es ein blockförmiger Feststoff, der einer eis- und orangefarbenen Farbe ähnelt..
Es hat einen chlorähnlichen Geruch. Es ist giftig beim Einatmen.
Erhalten
Es kann auf verschiedene Arten erhalten werden. Zum Beispiel in einigen Fällen ClO-Lösungenzwei werden hergestellt, indem ein Gemisch aus Chlorgas (Clzwei) und Luft (oder Chlorgas und Stickstoff N.zwei) durch eine Säule, die Natriumchloritgranulat (NaClO) enthältzwei).
2 NaClOzwei + Clzwei → 2 NaCl + 2 ClOzwei
Das erzeugte Produkt enthält ungefähr 90% ClOzwei, unter anderen Chlorverbindungen.
Es wird auch aus Kaliumchlorat (KClO) erhalten3) und Schwefelsäure (H.zweiSW4) in Gegenwart von Oxalsäure als Reduktionsmittel. In diesem Fall Kohlendioxid (COzwei) verwendet, um den ClO zu verdünnenzwei.
Es kann am Einsatzort ausgehend von Natriumchlorat (NaClO) hergestellt werden3), Schwefelsäure (H.zweiSW4) und Methanol (CH3OH).
In der Industrie wird es durch Natriumchlorat (NaClO) erhalten3) und Schwefeldioxid (SOzwei) in Gegenwart von Schwefelsäure.
2 NaClO3 + SWzwei + H.zweiSW4 → 2 ClOzwei + 2 NaHSO4
Wird als Desinfektionsmittel verwendet
Es kann als starkes antimikrobielles Mittel verwendet werden. Es hat sich als hochwirksam gegen verschiedene Mikroorganismen erwiesen, wie z Escherichia coli und der Staphylococcus aureus.
Bei letzterem reicht eine Konzentration von nur 5 ppm ClO auszwei 100% von ihnen zu beseitigen. Es ist bakterizid, antiseptisch und desodorierend. Es ist über einen weiten pH-Bereich wirksam.
Im Essen
Es wird als antimikrobielles Mittel in Wasser zur Begasung von Obst und Gemüse, bei der Verarbeitung von Geflügel, rotem Fleisch, Fleisch- und Organstücken sowie Meeresprodukten wie Schalentieren verwendet..

Chlordioxidlösungen sollten in einer Konzentration von nicht mehr als 3 ppm (parts per million) ClO verwendet werdenzwei Rest, so dass es keine Auswirkungen auf Lebensmittel hat.
Nach der Behandlung mit ClOzwei Alle Lebensmittel müssen gründlich mit Trinkwasser gespült werden oder zum Blanchieren, Kochen oder Einmachen bestimmt sein.
Bei Schiffsprodukten die ClO-Lösungzwei Es sollte in Wasser und Eis verwendet werden, die zum Spülen, Waschen, Auftauen, Transportieren oder Lagern verwendet werden. Rohe Schalentiere sollten dann vor dem Verzehr gründlich mit Trinkwasser gewaschen werden..

Auf Papier und Pappe, die mit Lebensmitteln in Kontakt kommen
ClO-Lösungenzwei werden verwendet, um schleimverursachende Mikroorganismen (wie Algen, Bakterien und Pilze) im Prozesswasser zu entfernen, das bei der Herstellung von Papier und Pappe verwendet wird und mit Lebensmitteln in Kontakt kommt.
Im Trinkwasser
Es wird verwendet, um Wasser zu reinigen und es trinkbar zu machen (trinkbar). Es wird zur Vorbehandlung von Wasser verwendet, das später zum Trinken in Flaschen abgefüllt wird, oder von Wasser, das als Zutat bei der Herstellung von Getränken oder Erfrischungsgetränken verwendet wird..

In der Zahnmedizin
Es wird in Instrumenten verwendet, die vom Zahnarzt oder Zahnarzt verwendet werden, um sie zu desinfizieren und pathogene Organismen in ihnen zu zerstören.
In medizinischen Anwendungen
Wässrige Lösungen von ClOzwei wurden zur Behandlung von oralen Hefeinfektionen (Infektion im Mund) verwendet. Candidiasis ist eine durch den Pilz verursachte Infektion Candida albicans.
Chlordioxid tötet Mundpilz ab und verbessert das Erscheinungsbild von Mundgewebe ohne Nebenwirkungen erheblich.
Einige medizinische Forscher weisen darauf hin, dass ClO-Lösungenzwei Die Anwendung auf Wunden bei chirurgischen Eingriffen kann die Adhäsionsbildung verringern oder unterdrücken, ohne die Heilung zu beeinträchtigen, mit dem zusätzlichen Vorteil seiner antiseptischen Eigenschaften.
Andere Verwendungen
Aufgrund seiner oxidierenden und mikrobiziden Eigenschaften ist ClOzwei wird verwendet für:
- Bleichen Sie Zellstoff aus Holz in der Zellstoff- und Papierherstellung und sorgen Sie für einen stabilen Glanz.
- Bleichen von Fetten und Ölen, Leder, Bleichen von Mehl und Textilien.
- Landwirtschaftliche Anwendungen wie Desinfektion von harten Oberflächen, Geräten, Wassersystemen und Pilzgewächshäusern.
- Anwendungen in Branchen, Geschäften und Krankenhäusern wie Desinfektion harter Oberflächen (Wände, Böden, Badezimmer), Lüftungssysteme, Laborgeräte.
- Desinfizieren Sie Fußböden und Badezimmer von Häusern, Klimaanlagen und Poolwasserzirkulationssystemen.
- Kommunale und industrielle Abwasserbehandlung.
- Bereinigung der Ölfeldverschmutzung.
- Herstellung von Chloridsalzen (Cl-).
Risiken
- Die konzentrierten Dämpfe von ClOzwei sind potenziell explosiv.
- Es ist giftig beim Einatmen und Verschlucken. Es reizt Augen, Nase und Rachen, kann Lungenödeme und chronische Bronchitis verursachen.
- Nach den konsultierten Quellen hat die ClOzwei verursacht beim Menschen keine DNA-Mutationen oder Krebs.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Chlordioxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Dean, J.A. (Editor). (1973). Langes Handbuch der Chemie (Elfte Ausgabe). McGraw-Hill Book Company.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Bajpai, P. (2012). Chlordioxid-Bleichen. Einfluss der Chlordioxidbleiche auf die Zellstoffqualität. In umweltfreundlichen Ansätzen für das Bleichen von Zellstoff (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Moran, S. (2018). Wasserchemie. Chlordioxid. In einem angewandten Leitfaden zur Auslegung von Wasser- und Abwasserbehandlungsanlagen. Von sciencedirect.com wiederhergestellt.
- McKeen, L. (2012). Einführung in die Bestrahlung von Lebensmitteln und die medizinische Sterilisation. Gasförmiges Chlordioxid. In der Wirkung der Sterilisation auf Kunststoffe und Elastomere (dritte Ausgabe). Von sciencedirect.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.