
Struktur, Eigenschaften, Verwendung, Produktion von Kaliumcarbonat (K2CO3)

Das Kaliumcarbonat ist eine anorganische Verbindung, die aus zwei Kalium-K-Ionen besteht+ und ein Carbonation CO3zwei-. Seine chemische Formel lautet K.zweiCO3. Es ist ein hygroskopischer weißer Feststoff, das heißt, es nimmt leicht Wasser aus der Umwelt auf. Aus diesem Grund wird es in Laboratorien verwendet, um Wasser aus anderen Substanzen aufzunehmen..
Es ist in Wasser sehr gut löslich und bildet alkalische Lösungen, die reich an OH-Ionen sind.-und daher mit einem hohen pH-Wert. Seine wässrigen Lösungen, die alkalisch sind, werden in verschiedenen industriellen Prozessen verwendet, um saure Gase wie Kohlendioxid CO zu absorbierenzwei und Schwefelwasserstoff H.zweiJa, es neutralisiert sie leicht.

Das KzweiCO3 Es wird zur Herstellung von Seifen, Reinigungsmitteln, Waschmitteln und Geschirrspülmischungen verwendet. Es wird auch bei der Verarbeitung einiger Textilfasern wie Wolle verwendet..
Es wird häufig in Chemielabors verwendet, um beispielsweise Wasser aus anderen Verbindungen zu absorbieren oder Gemische chemischer Reaktionen zu alkalisieren, und auch in der chemischen Analyse.
Es wird auch einigen Lebensmitteln zugesetzt, um beispielsweise den bitteren Geschmack von Kakaobohnen während der Herstellung von Schokolade zu beseitigen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Chemische Eigenschaften
- 4 Erhalten
- 5 Verwendungen
- 5.1 Bei der Absorption von CO2 in industriellen Prozessen
- 5.2 Bei der Entfernung von H2S aus bestimmten Prozessen
- 5.3 In Chemielabors
- 5.4 In der Reinigungsmittelindustrie
- 5.5 In der Lebensmittelindustrie
- 5.6 In Düngemitteln
- 5.7 In verschiedenen Anwendungen
- 6 Referenzen
Struktur
Kaliumcarbonat besteht aus zwei Kalium-K-Kationen+ und ein Carbonatanion CO3zwei-. Das Carbonatanion hat eine flache und symmetrische Struktur, während die drei Sauerstoffatome den Kohlenstoff umgeben und ein flaches Dreieck bilden..
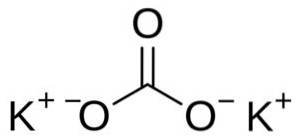
Nomenklatur
- Kaliumcarbonat
- Kaliumcarbonat
- Dikaliumcarbonat
- Pottasche
- Kaliumsalz der Kohlensäure.
Eigenschaften
Körperlicher Status
Farbloser bis weißer kristalliner Feststoff.
Molekulargewicht
138,205 g / mol.
Schmelzpunkt
899 ºC.
Siedepunkt
Es zersetzt sich.
Dichte
2,29 g / cm3
Löslichkeit
In Wasser sehr gut löslich: 111 g / 100 g Wasser bei 25 ° C. Unlöslich in Ethanol und Aceton.
pH
Eine wässrige Lösung kann einen pH-Wert von 11,6 haben, das heißt, sie ist ziemlich alkalisch.
Chemische Eigenschaften
Kaliumcarbonat ist zerfließend oder hygroskopisch, dh es nimmt Feuchtigkeit aus der Umgebung auf. Es hat ein stabiles Hydrat, K.zweiCO3.2HzweiODER.
Das KzweiCO3 in wässriger Lösung hydrolysiert es, dh es reagiert mit Wasser unter Freisetzung von OH-Gruppen- Welches sind diejenigen, die den Lösungen Alkalität verleihen:
CO3zwei- + H.zweiO ⇔ OH- + HCO3-
HCO3- + H.zweiO ⇔ OH- + H.zweiCO3
Erhalten
Es kann aus der Asche gewonnen werden, die beim Verbrennen von Pflanzen verbleibt. Auch durch Karbonatisierung von Kaliumhydroxid KOH, dh Zugabe von überschüssigem Kohlendioxid COzwei zu KOH:
KOH + COzwei → KHCO3
2 KHCO3 + Wärme → K.zweiCO3 + H.zweiODER
Ein anderer Weg, um es zu erhalten, ist das Erhitzen von Kaliumchlorid KCl mit Magnesiumcarbonat MgCO3, Wasser und COzwei unter Druck. Ein hydratisiertes Doppelsalz von Magnesium und Kalium wird zuerst MgCO erhalten3.KHCO3.4HzweiOder Engels-Salz genannt:
2 KCl + 3 MgCO3 + COzwei + 5 hzweiO → MgCO3.KHCO3.4HzweiO ↓ + MgClzwei
Engels hydratisiertes Doppelsalz fällt aus und wird aus der Lösung herausgefiltert. Dann wird es erhitzt und das Kaliumcarbonat K gebildetzweiCO3 dass sich bei Zugabe von Wasser Magnesiumcarbonat MgCO auflöst3 bleibt unlöslich und wird durch Filtration entfernt.
MgCO3.KHCO3.4HzweiO + Wärme → MgCO3↓ + 2K+ + CO3zwei- + COzwei↑ + 9 H.zweiODER
Anwendungen
Bei der Absorption von COzwei in industriellen Prozessen
Die Kaliumcarbonatlösung ist die klassische Behandlung zur Entfernung von Kohlendioxid COzwei in verschiedenen Prozessen, insbesondere bei Hochdruck- und Hochtemperaturanwendungen.

CO-Entfernungzwei tritt nach folgender Reaktion auf:
K.zweiCO3 + COzwei + H.zweiO ⇔ 2 KHCO3
Diese Methode wird beispielsweise zur Behandlung von Erdgas eingesetzt. Auch in Kraftwerken, um die Emission von CO zu vermeidenzwei in die Atmosphäre und bei der Herstellung von Trockeneis.

Ks LösungzweiCO3 kann thermisch regeneriert werden, dh durch Erhitzen auf Temperaturen um 100 ° C..
Damit die Kaliumcarbonatlösung das CO2 mit einer guten Geschwindigkeit absorbieren kann, werden Promotoren hinzugefügt, die den Prozess beschleunigen, wie Diethanolamin (DEA)..
Bei der Entfernung von H.zweiS bestimmter Prozesse
Kaliumcarbonatlösungen werden auch verwendet, um Schwefelwasserstoffgas H zu entfernenzweiS für Prozessströme. Manchmal wird Kalium-K-Triphosphat zugesetzt3PO4 um den Prozess zu beschleunigen.
In Chemielabors
Das KzweiCO3 Es ermöglicht organische Synthesen, beispielsweise in Kondensationsreaktionen, und neutralisiert. Es wird verwendet, um Wasser aus organischen Flüssigkeiten als Dehydratisierungs- oder Trockenmittel im Labor zu entfernen.
Es wird auch in analytischen chemischen Reaktionen und zur Alkalisierung in der pharmazeutischen Industrie verwendet..
In der Reinigungsmittelindustrie
Das KzweiCO3 Es wird zur Herstellung von Seife, Reinigungsformeln, Wäsche- und Geschirrspülmitteln sowie zur Herstellung von Shampoo und anderen Körperpflegeprodukten verwendet.

In der Lebensmittelindustrie
Kaliumcarbonat wird verschiedenen Lebensmitteln für verschiedene Zwecke zugesetzt.
Zum Beispiel wird es Kakaobohnen zugesetzt, um ihren bitteren Geschmack zu entfernen und sie bei der Herstellung von Schokolade zu verwenden. Es wird den Trauben während des Trocknungsprozesses zugesetzt, um Rosinen zu erhalten.

Im Gebäck wird es als Treibmittel (das als Hefe wirkt) für Mehl zur Herstellung von Backwaren verwendet..

In Düngemitteln
Das KzweiCO3 Es wird verwendet, um saure Böden zu düngen, da das Carbonation CO3zwei- in Kontakt mit Wasser entstehen OH-Ionen- das erhöht den pH-Wert des Bodens. Plus Kalium K.+ Es ist ein Nährstoff für Pflanzen.
Kaliumcarbonat wurde auch zur Herstellung von Düngemitteln mit langsamer Freisetzung verwendet.
Ein langsam freisetzender Dünger setzt Nährstoffe langsam frei oder setzt sie frei, damit sie nicht aufgelöst und weggespült werden. Dank dessen können sie mehr Zeit für die Wurzeln der Pflanze aufwenden.
In verschiedenen Anwendungen
Kaliumcarbonat K.zweiCO3 es wird auch verwendet, um:
- Färbe-, Bleich- und Reinigungsverfahren für Rohwolle und andere Aktivitäten der Textilindustrie
- Erhalten anderer organischer und anorganischer Kaliumsalze wie KCN-Kaliumcyanid.
- Funktion als Säureregulator in verschiedenen Prozessen.
- Herstellung von Keramik und Keramik.
- Gravur- und Lithographieverfahren.
- Gerben und Veredeln von Leder.
- Bereiten Sie Tinten zum Drucken vor, Pigmente.
- Brille speziell für das Fernsehen herstellen, da die K.zweiCO3 ist verträglicher als Natriumcarbonat NazweiCO3 mit Blei, Barium und Strontiumoxiden in diesen Gläsern.
- Wasserversorgung.
- Feuerhemmend (in Form von wässrigen Lösungen).
- Korrosion verhindern und als Antifoulingmittel in Prozessanlagen.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Kaliumcarbonat. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Steele, D. (1966). Die Chemie der metallischen Elemente. Pergamon Press Ltd. London.
- Mokhatab, S. et al. (2019). Erdgasbehandlung. Die Kaliumcarbonatlösung. Im Handbuch der Erdgasübertragung und -verarbeitung (4. Auflage). Von sciencedirect.com wiederhergestellt.
- Kakaras, E. et al. (2012). Kombikreislaufsysteme mit Druckfließbettverbrennung (PFBC). Druckbettverbrennung mit Kohlenstoffabscheidung und -speicherung. In kombinierten Kreislaufsystemen zur Erzeugung von emissionsarmer Energie. Von sciencedirect.com wiederhergestellt.
- Speight, J.G. (2019). Wasserstoffproduktion. Nassschrubben. Bei der Rückgewinnung und Aufrüstung von Schweröl. Von sciencedirect.com wiederhergestellt.
- Branan, C.R. (2005). Gasbehandlung: Kapitel aktualisiert von Chris Higman. Heißkarbonatprozesse. In Faustregeln für Chemieingenieure (4. Auflage). Von sciencedirect.com wiederhergestellt.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Sons.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. VCH Verlagsgesellschaft mbH.
- Li, Y. und Cheng, F. (2016). Synthese eines neuartigen Kaliumdüngers mit langsamer Freisetzung aus modifizierter Pidgeon-Magnesiumschlacke durch Kaliumcarbonat. J Air Waste Manag Assoc, 2016 Aug; 66 (8): 758 & ndash; 67. Von ncbi.nlm.nih.gov wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.