
Kompressibilitätsfaktor wie zu berechnen, Beispiele und Übungen
Das Kompressibilitätsfaktor Z., oder Kompressionsfaktor für Gase ist ein dimensionsloser Wert (ohne Einheiten), der als Korrektur in die Zustandsgleichung idealer Gase eingeführt wird. Auf diese Weise ähnelt das mathematische Modell eher dem beobachteten Verhalten von Gas..
Im idealen Gas lautet die Zustandsgleichung, die sich auf die Variablen P (Druck), V (Volumen) und T (Temperatur) bezieht: P.V. Ideal = n.R.T. mit n = Molzahl und R = ideale Gaskonstante. Addiert man die Korrektur für den Kompressibilitätsfaktor Z, so ergibt sich folgende Gleichung:
P.V = Z.n.R.T.
Artikelverzeichnis
- 1 Berechnung des Kompressibilitätsfaktors?
- 2 Beispiele
- 2.1 Der Kompressibilitätsfaktor in idealen Gasen, Luft, Wasserstoff und Wasser
- 3 Gelöste Übungen
- 3.1 Übung 1
- 3.2 Übung 2
- 4 Referenzen
Berechnung des Kompressibilitätsfaktors?
Unter Berücksichtigung, dass das Molvolumen ist V.cool = V / n, Wir haben das reale Molvolumen:
P. . V.Real = Z. R. T → Z = PV Real/ RT
Da der Kompressibilitätsfaktor Z von den Gasbedingungen abhängt, wird er als Funktion von Druck und Temperatur ausgedrückt:
Z = Z (P, T)
Wenn man die ersten beiden Gleichungen vergleicht, kann man sehen, dass, wenn die Anzahl der Mol n gleich 1 ist, das Molvolumen eines realen Gases mit dem des idealen Gases in Beziehung steht durch:
V.Real / V.Ideal = Z → V. Real = Z V.Ideal
Wenn der Druck 3 Atmosphären überschreitet, verhalten sich die meisten Gase nicht mehr wie ideale Gase, und das tatsächliche Volumen weicht erheblich vom Ideal ab.
Dies wurde in seinen Experimenten vom niederländischen Physiker Johannes Van der Waals (1837-1923) realisiert, die ihn dazu veranlassten, ein Modell zu erstellen, das für praktische Ergebnisse besser geeignet war als die ideale Gasgleichung: die Van-Zustandsgleichung. Der Waals.
Beispiele
Nach der Gleichung P.V.Real= Z.n.RT., Für ein ideales Gas ist Z = 1. In realen Gasen steigt jedoch mit zunehmendem Druck auch der Wert von Z. Dies ist sinnvoll, da die Gasmoleküle umso mehr Kollisionsmöglichkeiten haben, je höher der Druck ist, weshalb die Abstoßungskräfte zunehmen und damit die Lautstärke.
Andererseits bewegen sich die Moleküle bei niedrigeren Drücken freier und die Abstoßungskräfte nehmen ab. Daher wird ein geringeres Volumen erwartet. Wenn die Temperatur ansteigt, nimmt Z ab.
Wie Van der Waals feststellte, weicht das Verhalten des Gases in der Nähe des sogenannten kritischen Punktes stark von dem eines idealen Gases ab..
Der kritische Punkt (T.c, P.c) eines Stoffes sind die Druck- und Temperaturwerte, die sein Verhalten vor einem Phasenwechsel bestimmen:
-T.c ist die Temperatur, oberhalb derer sich das betreffende Gas nicht verflüssigt.
-P.c ist der Mindestdruck, der erforderlich ist, um das Gas bei der Temperatur T zu verflüssigenc
Jedes Gas hat jedoch seinen eigenen kritischen Punkt, der die Temperatur und den reduzierten Druck T definiertr Und Pr wie folgt:
P.r = P / P.c
V.r = V / V.c
T.r = T / T.c
Es wird beobachtet, dass ein eingeschlossenes Gas identisch ist V.r Y. T.r übt den gleichen Druck aus P.r. Aus diesem Grund, wenn Z als Funktion von aufgetragen ist P.r zu sich selbst T.r, Jeder Punkt auf dieser Kurve ist für jedes Gas gleich. Das nennt man Prinzip der entsprechenden Zustände.
Der Kompressibilitätsfaktor in idealen Gasen, Luft, Wasserstoff und Wasser
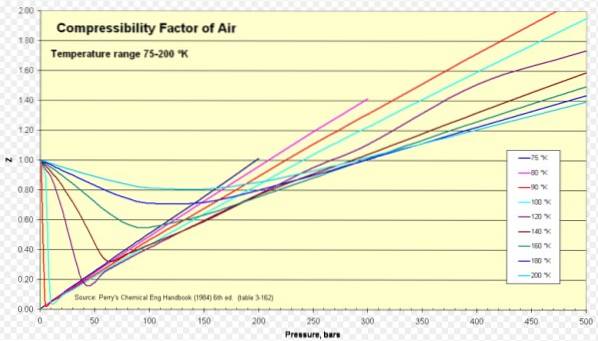
Nachfolgend finden Sie eine Kompressibilitätskurve für verschiedene Gase bei verschiedenen reduzierten Temperaturen. Hier sind einige Beispiele für Z für einige Gase und ein Verfahren zum Ermitteln von Z anhand der Kurve.
Ideale Gase
Ideale Gase haben Z = 1, wie zu Beginn erläutert.
Luft
Für Luft ist Z in einem weiten Bereich von Temperaturen und Drücken ungefähr 1 (siehe Abbildung 1), wobei das ideale Gasmodell sehr gute Ergebnisse liefert.
Wasserstoff
Z> 1 für alle Drücke.
Wasser
Um Z für Wasser zu finden, benötigen Sie die kritischen Punktwerte. Der kritische Punkt des Wassers ist: P.c = 22,09 MPa und T.c= 374,14 ° C (647,3 K). Auch hier ist zu berücksichtigen, dass der Kompressibilitätsfaktor Z von Temperatur und Druck abhängt..
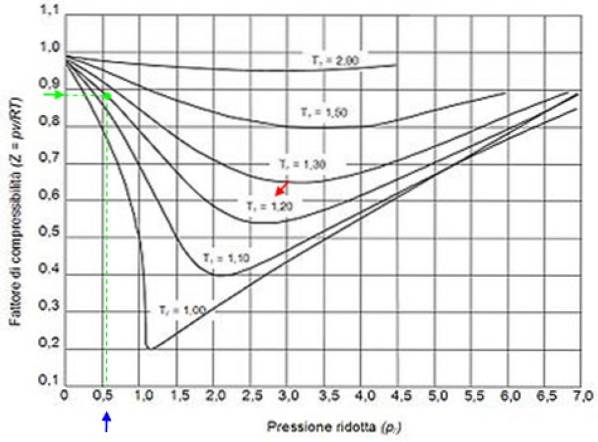
Angenommen, Sie möchten Z Wasser bei 500 ºC und 12 MPa finden. Dann müssen Sie zunächst die reduzierte Temperatur berechnen, für die die Grad Celsius in Kelvin umgerechnet werden müssen: 50 ºC = 773 K:
T.r = 773 / 647,3 = 1,2
P.r = 12 / 22.09 = 0,54
Mit diesen Werten platzieren wir im Diagramm der Figur die Kurve, die T entsprichtr = 1,2, angezeigt durch einen roten Pfeil. Als nächstes suchen wir nach dem Wert von P auf der horizontalen Achser näher an 0,54, blau markiert. Jetzt zeichnen wir eine Vertikale, bis wir die Kurve T abfangenr = 1,2 und schließlich wird es von diesem Punkt auf die vertikale Achse projiziert, wo wir den ungefähren Wert von Z = 0,89 lesen.
Gelöste Übungen
Übung 1
Es gibt eine Gasprobe bei einer Temperatur von 350 K und einem Druck von 12 Atmosphären mit einem Molvolumen, das 12% größer ist als das durch das ideale Gasgesetz vorhergesagte. Berechnung:
a) Kompressionsfaktor Z..
b) Molvolumen des Gases.
c) Geben Sie gemäß den vorherigen Ergebnissen an, welche die dominierenden Kräfte in dieser Gasprobe sind.
Daten: R = 0,082 l / min
Lösung für
Wissen, dass V. Real ist 12% größer als V.Ideal ::
V.Real = 1,12 V.Ideal
Z = V. Real / V.Ideal = 1,12
Lösung b
P. P. V.Real = Z. R. T → V.Real = (1,12 × 0,082 × 350/12) L / Mol = 2,14 L / Mol.
Lösung c
Die Abstoßungskräfte sind diejenigen, die überwiegen, da das Volumen der Probe zunahm.
Übung 2
Es gibt 10 Mol Ethan, die in einem Volumen von 4,86 l bei 27 ° C eingeschlossen sind. Finden Sie den Druck, den Ethan ausübt, aus:
a) Das ideale Gasmodell
b) Die Van-der-Waals-Gleichung
c) Ermitteln Sie den Komprimierungsfaktor aus den vorherigen Ergebnissen.
Daten für Ethan
Van-der-Waals-Koeffizienten:
a = 5.489 dm6. Geldautomat. Maulwurf-zwei und b = 0,06380 dm3. Maulwurf-1.
Kritischer Druck: 49 atm. Kritische Temperatur: 305 K.
Lösung für
Die Temperatur wird an Kelvin übergeben: 27 º C = 27 + 273 K = 300 K, denken Sie auch daran, dass 1 Liter = 1 L = 1 dm3.
Dann werden die gelieferten Daten in die ideale Gasgleichung eingesetzt:
P. V = n.R.T → P = (10 × 0,082 × 300 / 4,86 l) atm = 50,6 atm
Lösung b
Die Van-der-Waals-Zustandsgleichung lautet:
Wobei a und b die in der Anweisung angegebenen Koeffizienten sind. Beim Löschen von P:
Lösung c
Wir berechnen den reduzierten Druck und die reduzierte Temperatur:
P.r = 35,2 / 49 = 0,72
T.r = 300/305 = 0,98 ≤ 1
Mit diesen Werten suchen wir nach dem Wert von Z in der Grafik von Abbildung 2 und stellen fest, dass Z ungefähr 0,7 beträgt.
Verweise
- Atkins, P. 1999. Physikalische Chemie. Omega-Ausgaben.
- Cengel, Y. 2012. Thermodynamik. 7ma Auflage. Mcgraw Hügel.
- Engel, T. 2007. Einführung in die Physikochemie: Thermodynamik. Pearson.
- Levine, I. 2014. Prinzipien der Physikochemie. 6 .. Auflage. Mcgraw Hügel.
- Wikipedia. Kompressibilitätsfaktor. Wiederhergestellt von: en.wikipedia.org.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.